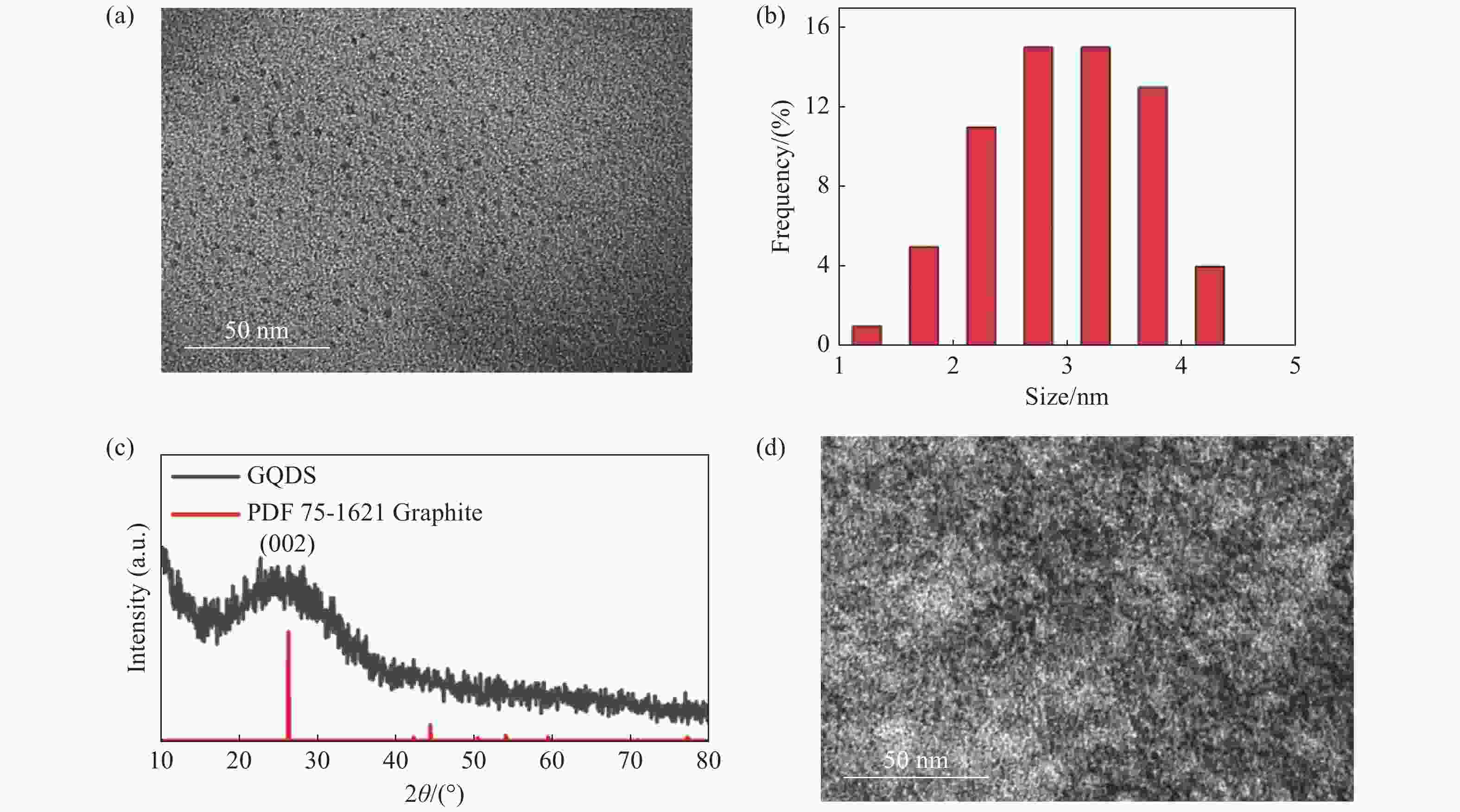
-
摘要:
本文详细研究了交联剂1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)对石墨烯量子点(GQDs)光学性质的影响及原因。采用水热法制备了GQDs,并与EDC反应得到GQDs/EDC复合物,对GQDs和GQDs/EDC的光谱特性进行研究。使用PBS溶液以及人工胃液样品,研究pH对GQDs/EDC荧光影响规律及作用机理。实验结果表明:GQDs表面缺陷被EDC钝化,使得GQDs的荧光在小于1 min内迅速增强,并在5~20 min内保持稳定;相比单独GQDs,GQDs/EDC的荧光强度显著提升约264倍;pH响应实验表明,在pH值为1.75~4.01及4.01~9.28范围内,GQDs/EDC具有荧光和吸收强度线性响应规律。生物兼容性表明,在25~300 µg/mL样品浓度下,人乳腺癌细胞存活率均大于80%;同时,对人工胃液pH具有较高的检测准确性,其相对标准偏差RSD ≤ 1.10%。EDC介导的荧光增强,使GQDs在检测、传感、成像等领域更具优势。同时,GQDs/EDC灵敏的pH响应特性使其在pH值检测应用中具有良好前景。
Abstract:In this paper, the effect of the cross-linking agent 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (EDC) on the optical properties of graphene quantum dots (GQDs) and the reasons are investigated in detail. GQDs were prepared by a hydrothermal method and reacted with EDC to obtain GQDs/EDC composites. The spectral properties of GQDs and GQDs/EDC were investigated. The effect of pH on the fluorescence of GQDs/EDC and its mechanism were investigated using PBS solution and artificial gastric juice samples. The experimental results show that EDC passives the surface defects of GQDs, making the fluorescence of GQDs increase rapidly in <1 min time and remain stable up to 20 min. Under different EDC contents the fluorescence intensity of GQDs/EDC is significantly enhanced by about 264 times compared to GQDs alone. The pH response experiments shows that GQDs/EDC had a linear response pattern of fluorescence and absorption intensity in the pH range of 1.75−4.01 and 4.01−9.28. Biocompatibility showed that the cell viability of human breast cancer cells was greater than 80% at sample concentrations of 25−300 µg/mL and remained at 74% even at high concentrations of 500 µg/mL; Finally, the detection of artificial gastric pH has high accuracy with relative standard deviation RSD ≤1.10%. The EDC-mediated fluorescence enhancement makes GQDs more advantageous in the fields of detection, sensing and imaging. Besides, the sensitive pH response characteristics of GQDs/EDC provide a good prospect for pH detection applications.
-
Key words:
- graphene quantum dots /
- EDC /
- fluorescence enhancement /
- surface passivation /
- pH response
-
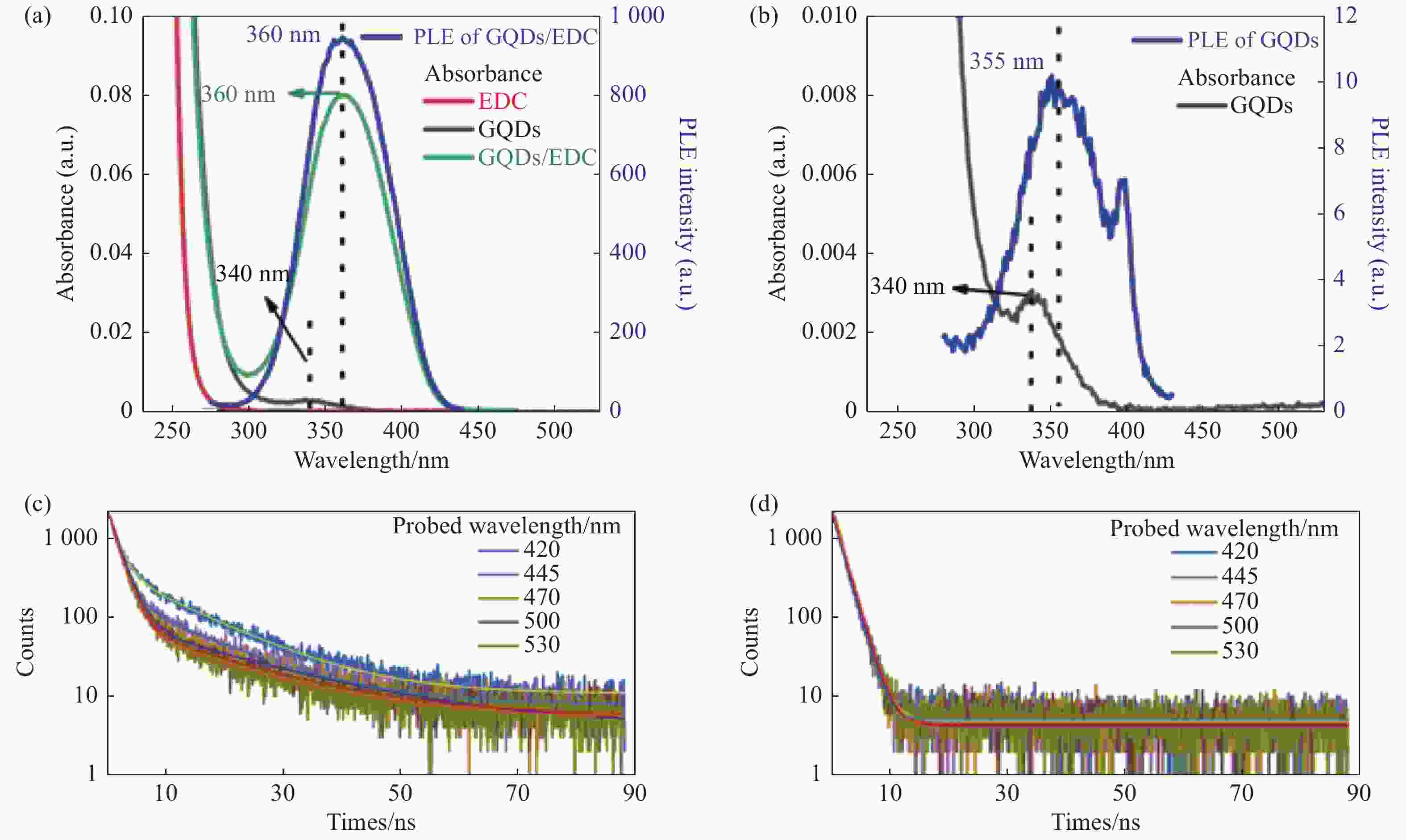
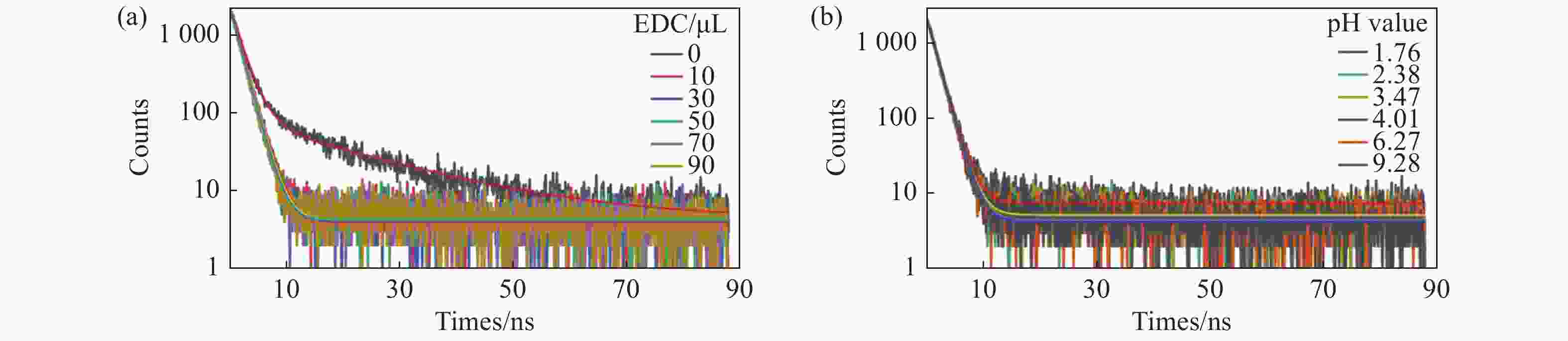
图 5 (a)EDC,GQDs,GQDs/EDC的吸收光谱,以及460 nm探测波长下GQDs/EDC的激发光谱。(b)GQDs的吸收光谱及其460 nm探测波长下的激发光谱。(c)GQDs和(d)GQDs/EDC在不同探测波长下的瞬态PL衰减曲线。各样品最终体积定容至2 mL,EDC含量为50 µL,15.28 mg/mL
Figure 5. (a) Absorption spectra of EDC, GQDs, GQDs/EDC, and excitation spectrum of GQDs/EDC at 460 nm detection wavelength. (b) Absorption spectrum of GQDs and excitation spectrum at 460 nm detection wavelength. Transient PL decay curves of (c) GQDs and (d) GQDs/EDC at different detection wavelengths. The final volume of each sample was 2 mL and EDC content is 50 µL, 15.28 mg/mL
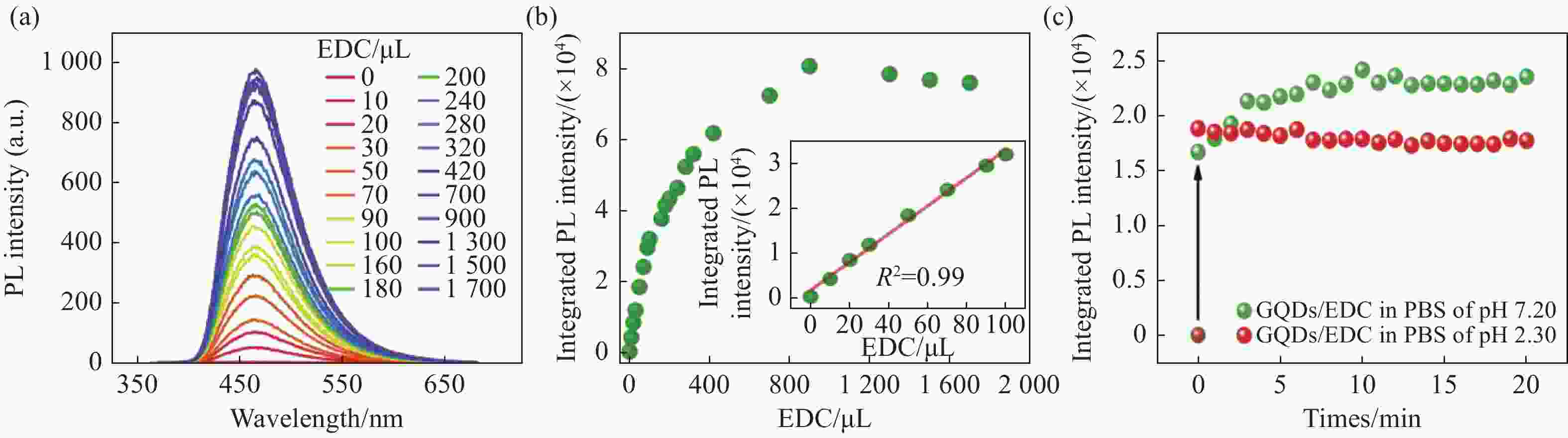
图 6 (a)GQDs分别与浓度为0~1700 µL的EDC混合反应后的荧光光谱以及(b) 荧光积分强度随EDC含量的变化趋势图。(c)pH值分别为7.2和2.3条件下,荧光积分强度随GQDs与EDC反应时间的变化关系
Figure 6. (a) Fluorescence spectra of GQDs/EDC with different EDC contents (0−1700 µL), and (b) the trend of fluorescence integrated intensity with EDC content. (c) The integrated PL intensity varies with the reaction time of GQDs/ EDC with the pH value of 7.2 and 2.3, respectively
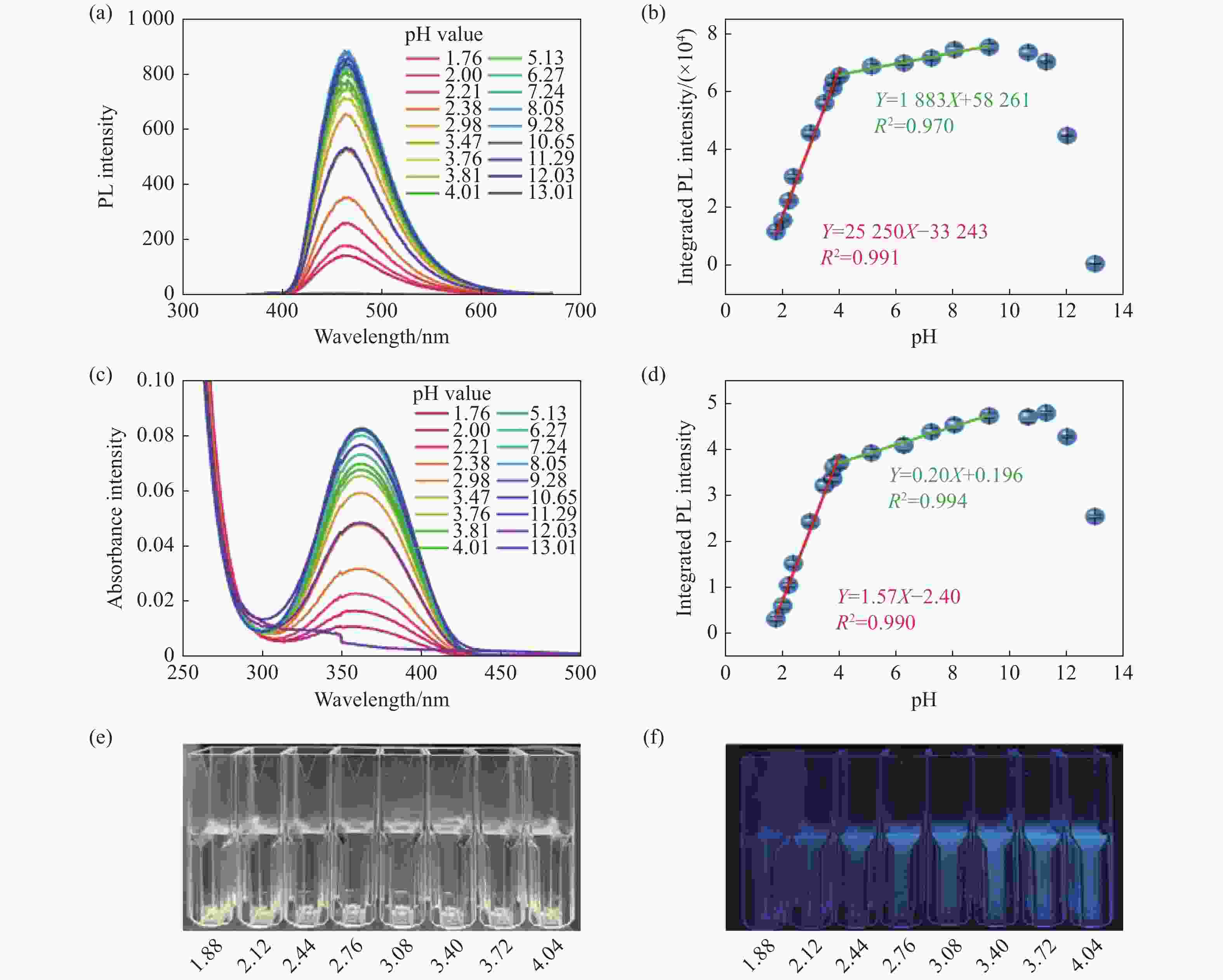
图 7 不同pH环境下的GQDs/EDC混合反应10 min后测得的(a)荧光光谱(λex=360 nm)和(c)吸收光谱。以及去基线后(b)荧光积分强度和(d)吸收积分强度随pH值的变化曲线。以及不同pH环境下GQDs/EDC的(e)明场和365 nm光源激发下的(f)暗场实物图
Figure 7. (a) Fluorescence spectra (λex=360 nm) and (c) absorption spectra of EDC and GQDs at different pH values after 10 min mixed reaction. (b) Integrated fluorescence and (d) absorption intensity as a function of pH value, after removing the baseline. (e) Bright-field and (f) dark-field images of GQDs/EDC under different pH environments with excitation by a 365 nm light source
图 9 (a)选择性测试,GQDs/EDC对H+和其他常用离子 (5 mM)的荧光强度响应,其中Blank组为仅有PBS(pH 7.2)溶液(b)细胞与不同浓度GQDs/EDC共培养24 h后,MTT法测得的MCF-7细胞存活率
Figure 9. (a) Selective tests, the fluorescence intensity response of GQDs/EDC to H+ and other commonly used ions (5 mM), the Blank group was only PBS (pH 7.2) solution. (b) The survival rate of MCF-7 cells was determined by MTT method after 24 h co-culture with different concentrations of GQDs/ EDC
表 1 不同方法的量子点荧光法测定pH值比较结果
Table 1. Comparison of pH values of quantum dots by different fluorometric determination methods
Sensors Medium Linear range Ref N,S co-doped carbon QDs Intracellular 5.5~7.0 [28] Carbon dots Intracellular 6.1~7.8 [29] Carbon dots Intracellulat 6.03~8.91 [30] N-doped GQDs Aqueous solution 1.25~13.56 [31] CMC/GODs Hydrogels film Not given [32] GQDs Intracellular Not given [33] CuInS2/ZnS ODs Aqueous solution 5.7~8 [34] GODs Aqueous solution 1.76~4.01
4.01~9.28This work 表 2 胃液pH值的测定
Table 2. Determination of pH value of gastric juices
Gastric juice sample pH value RSD (%)b Glass electrodea Proposed methoda 1 1.81±0.01 1.83±0.02 0.92 2 2.13±0.02 2.18±0.01 0.60 3 2.46±0.01 2.39±0.03 1.10 a平均值±标准差(n=3);b相对标准偏差 -
[1] ZHANG M K, LIU W D, GONG Y P, et al. Graphene/quantum dot heterostructure photodetectors: from material to performance[J]. Advanced Optical Materials, 2022, 10(24): 2201889. doi: 10.1002/adom.202201889 [2] KAUR A, PANDEY K, KAUR R, et al. Nanocomposites of carbon quantum dots and graphene quantum dots: environmental applications as sensors[J]. Chemosensors, 2022, 10(9): 367. doi: 10.3390/chemosensors10090367 [3] BARATI F, AVATEFI M, MOGHADAM N B, et al. A review of graphene quantum dots and their potential biomedical applications[J]. Journal of Biomaterials Applications, 2023, 37(7): 1137-1158. doi: 10.1177/08853282221125311 [4] ROY D, FOUZDER C, MUKHUTY A, et al. Designed synthesis of dual emitting silicon quantum dot for cell imaging: direct labeling of alpha 2-HS-glycoprotein[J]. Bioconjugate Chemistry, 2019, 30(5): 1575-1583. doi: 10.1021/acs.bioconjchem.9b00279 [5] GIDWANI B, SAHU V, SHUKLA S S, et al. Quantum dots: prospectives, toxicity, advances and applications[J]. Journal of Drug Delivery Science and Technology, 2021, 61: 102308. doi: 10.1016/j.jddst.2020.102308 [6] WADHWA S, JOHN A T, NAGABOOSHANAM S, et al. Graphene quantum dot-gold hybrid nanoparticles integrated aptasensor for ultra-sensitive detection of vitamin D3 towards point-of-care application[J]. Applied Surface Science, 2020, 521: 146427. doi: 10.1016/j.apsusc.2020.146427 [7] XUE G, YU S, QIANG ZH, et al. Application of maleimide modified graphene quantum dots and porphyrin fluorescence resonance energy transfer in the design of ‘‘turn-on’’ fluorescence sensors for biothiols[J]. Analytica Chimica Acta, 2020, 1108: 46-53. doi: 10.1016/j.aca.2020.01.062 [8] ZHU SH J, SONG Y B, ZHAO X H, et al. The photoluminescence mechanism in carbon dots (graphene quantum dots, carbon nanodots, and polymer dots): current state and future perspective[J]. Nano Research, 2015, 8(2): 355-381. doi: 10.1007/s12274-014-0644-3 [9] PAN J H, ZHENG Z Y, YANG J Y, et al. A novel and sensitive fluorescence sensor for glutathione detection by controlling the surface passivation degree of carbon quantum dots[J]. Talanta, 2017, 166: 1-7. doi: 10.1016/j.talanta.2017.01.033 [10] HE T, QI L, ZHANG J, et al. Enhanced graphene quantum dot fluorescence nanosensor for highly sensitive acetylcholinesterase assay and inhibitor screening[J]. Sensors and Actuators B:Chemical, 2015, 215: 24-29. doi: 10.1016/j.snb.2015.03.043 [11] ACHADU O J, BRITTON J, NYOKONG T. Graphene quantum dots functionalized with 4-amino-2, 2, 6, 6-tetramethylpiperidine-N-oxide as fluorescence “turn-ON” nanosensors[J]. Journal of Fluorescence, 2016, 26(6): 2199-2212. doi: 10.1007/s10895-016-1916-y [12] JIN L, WANG Y, YAN F K, et al. The synthesis and application of nitrogen-doped graphene quantum dots on brilliant blue detection[J]. Journal of Nanomaterials, 2019, 2019: 1471728. [13] DONG Y Q, LIN J P, CHEN Y M, et al. Graphene quantum dots, graphene oxide, carbon quantum dots and graphite nanocrystals in coals[J]. Nanoscale, 2014, 6(13): 7410-7415. doi: 10.1039/C4NR01482K [14] 于宏伟, 王晓萱, 张雨萱, 等. 柠檬酸中红外光谱研究[J]. 江苏调味副食品,2021(1):29-32.YU H W, WANG X X, ZHANG Y X, et al. On the infrared spectroscopy of citric acid[J]. Jiangsu Condiment and Subsidiary Food, 2021(1): 29-32. (in Chinese) [15] DONG Y Q, SHAO J W, CHEN C Q, et al. Blue luminescent graphene quantum dots and graphene oxide prepared by tuning the carbonization degree of citric acid[J]. Carbon, 2012, 50(12): 4738-4743. doi: 10.1016/j.carbon.2012.06.002 [16] ZHUANG Q F, WANG Y, NI Y N. Solid-phase synthesis of graphene quantum dots from the food additive citric acid under microwave irradiation and their use in live-cell imaging[J]. Luminescence, 2016, 31(3): 746-753. doi: 10.1002/bio.3019 [17] SAMRA K S, MANPREET, SINGH A. Facile synthesis of graphene quantum dots and their optical characterization[J]. Fullerenes,Nanotubes and Carbon Nanostructures, 2021, 29(8): 638-642. doi: 10.1080/1536383X.2021.1878152 [18] FACURE M H M, SCHNEIDER R, MERCANTE L A, et al. Rational hydrothermal synthesis of graphene quantum dots with optimized luminescent properties for sensing applications[J]. Materials Today Chemistry, 2022, 23: 100755. doi: 10.1016/j.mtchem.2021.100755 [19] PANYATHIP R, SUCHARITAKUL S, PHADUANGDHITIDHADA S, et al. Surface enhanced Raman scattering in graphene quantum dots grown via electrochemical process[J]. Molecules, 2021, 26(18): 5484. doi: 10.3390/molecules26185484 [20] GAO L, WANG Y W, LU M, et al. Simple method for O-GlcNAc sensitive detection based on graphene quantum dots[J]. RSC Advances, 2017, 7(50): 31204-31211. doi: 10.1039/C7RA02643A [21] MURPHY K R. A note on determining the extent of the water Raman peak in fluorescence spectroscopy[J]. Applied Spectroscopy, 2011, 65(2): 233-236. doi: 10.1366/10-06136 [22] KHARANGARH P R, UMAPATHY S, SINGH G. Investigation of sulfur related defects in graphene quantum dots for tuning photoluminescence and high quantum yield[J]. Applied Surface Science, 2018, 449: 363-370. doi: 10.1016/j.apsusc.2018.01.026 [23] QU D, ZHANG M, LI J, et al. Tailoring color emission from N-doped graphene quantum dots for bioimaging applications[J]. Light:Science &Application, 2015, 4(12): e364. doi: 10.1038/lsa.2015.137 [24] ZHU SH J, SHAO J R, SONG Y B, et al. Investigating the surface state of graphene quantum dots[J]. Nanoscale, 2015, 7(17): 7927-7933. doi: 10.1039/C5NR01178G [25] CHUNG S, REVIA R A, ZHANG M Q. Graphene quantum dots and their applications in bioimaging, biosensing, and therapy[J]. Advanced Materials, 2021, 33(22): 1904362. doi: 10.1002/adma.201904362 [26] PU CH D, QIN H Y, GAO Y, et al. Synthetic control of exciton behavior in colloidal quantum dots[J]. Journal of the American Chemical Society, 2017, 139(9): 3302-3311. doi: 10.1021/jacs.6b11431 [27] WANG L, ZHU SH J, WANG H Y, et al. Common origin of green luminescence in carbon nanodots and graphene quantum dots[J]. ACS Nano, 2014, 8(3): 2541-2547. doi: 10.1021/nn500368m [28] SONG ZH Q, QUAN F Y, XU Y H, et al. Multifunctional N, S co-doped carbon quantum dots with pH- and thermo-dependent switchable fluorescent properties and highly selective detection of glutathione[J]. Carbon, 2016, 104: 169-178. doi: 10.1016/j.carbon.2016.04.003 [29] SAFAVI A, AHMADI R, MOHAMMADPOUR Z, et al. Fluorescent pH nanosensor based on carbon nanodots for monitoring minor intracellular pH changes[J]. RSC Advances, 2016, 6(106): 104657-104664. doi: 10.1039/C6RA21556D [30] LIU J H, LI J ZH, XU L Q, et al. Facile synthesis of N, B-doped carbon dots and their application for multisensor and cellular imaging[J]. Industrial &Engineering Chemistry Research, 2017, 56(14): 3905-3912. [31] KURNIAWAN D, CHIANG W H. Microplasma-enabled colloidal nitrogen-doped graphene quantum dots for broad-range fluorescent pH sensors[J]. Carbon, 2020, 167: 675-684. doi: 10.1016/j.carbon.2020.05.085 [32] RAKHSHAEI R, NAMAZI H, HAMISHEHKAR H, et al. Graphene quantum dot cross-linked carboxymethyl cellulose nanocomposite hydrogel for pH-sensitive oral anticancer drug delivery with potential bioimaging properties[J]. International Journal of Biological Macromolecules, 2020, 150: 1121-1129. doi: 10.1016/j.ijbiomac.2019.10.118 [33] FAN Z T, ZHOU SH X, GARCIA C, et al. pH-responsive fluorescent graphene quantum dots for fluorescence-guided cancer surgery and diagnosis[J]. Nanoscale, 2017, 9(15): 4928-4933. doi: 10.1039/C7NR00888K [34] KOKTYSH D S. Ratiometric pH sensor using luminescent CuInS2/ZnS quantum dots and fluorescein[J]. Materials Research Bulletin, 2020, 123: 110686. doi: 10.1016/j.materresbull.2019.110686 [35] AI L, YANG Y S, WANG B Y, et al. . Insights into photoluminescence mechanisms of carbon dots: advances and perspectives[J]. Science Bulletin, 2021, 66(8): 839-856. [36] TACHI S, MORITA H, TAKAHASHI M, et al. Quantum yield enhancement in graphene quantum dots via esterification with benzyl alcohol[J]. Scientific Reports, 2019, 9(1): 14115. doi: 10.1038/s41598-019-50666-3 [37] ZHANG L, ZHANG ZH Y, LIANG R P, et al. Boron-doped graphene quantum dots for selective glucose sensing based on the “abnormal” aggregation-induced photoluminescence enhancement[J]. Analytical Chemistry, 2014, 86(9): 4423-4430. doi: 10.1021/ac500289c [38] VÝBORNÝ K, VALLOVÁ J, KOČÍ Z, et al. Genipin and EDC crosslinking of extracellular matrix hydrogel derived from human umbilical cord for neural tissue repair[J]. Scientific Reports, 2019, 9(1): 10674. doi: 10.1038/s41598-019-47059-x [39] MARTINSEN T C, BERGH K, WALDUM H L. Gastric juice: a barrier against infectious diseases[J]. Basic &Clinical Pharmacology &Toxicology, 2005, 96(2): 94-102. [40] MAKOLA D, PEURA D A, CROWE S E. Helicobacter pylori infection and related gastrointestinal diseases[J]. Journal of Clinical Gastroenterology, 2007, 41(6): 548-558. doi: 10.1097/MCG.0b013e318030e3c3 -





 下载:
下载: