Multicolor fluorescent emission of graphene oxide and its application in fluorescence imaging
-
摘要: 氧化石墨烯作为石墨烯的一种带隙打开的衍生物,极大地丰富了其光学性质,并拓展了它在传感和成像方面的应用,特别是氧化石墨烯限域的π共轭结构对构建发光碳材料提供了十分便利的条件。目前,有大量的研究工作报道了氧化石墨烯及其衍生物能够产生多种颜色的荧光信号,然而,系统地总结这些研究去揭示氧化石墨烯发光机理的相关工作还比较少。本文总结了关于发光氧化石墨烯纳米材料的合成及其在光学成像方面应用的大量研究工作,为进一步开发新型的发光氧化石墨烯材料提供一些建设性意见。Abstract: As an opened-bandgap derivative, graphene oxide greatly enriches its optical properties and extends its applications in sensing and imaging. In particular, graphene oxide-confined π-conjugated structures provide very favorable conditions for the construction of luminescent carbon materials. Nowadays, more and more works have reported that graphene oxide and its derivatives can generate multicolor fluorescent signals. However, systematically summarizing these studies to reveal the luminescence mechanism of graphene oxide are still relatively rare. In this paper, the synthesis of luminescent graphene oxide nanomaterials and their application in optical imaging are summarized, which provides some constructive suggestions for the further development of new luminescent graphene oxide materials.
-
Key words:
- graphene oxide /
- nanosheets /
- quantum dots /
- fluorescence /
- optical imaging
-
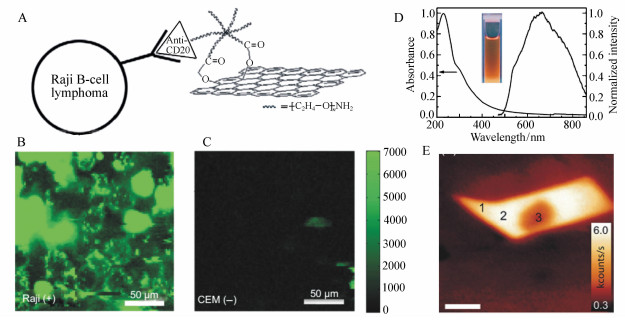
图 1 (A) NGO-PEG与anti-CD20抗体(利妥昔单抗)选择性的结合及其细胞成像示意图[31];(B)用NGO-PEG-Rituxan复合物处理CD20阳性表达的B淋巴细胞的NIR荧光图像[31];(C)用NGO-PEG-Rituxan复合物处理CD20阴性表达的人T细胞白血病细胞的NIR荧光图像[31];(D)GO胶体的紫外吸收和荧光发射光谱(插图:365 nm激发GO胶体的发光图像)[34];(E)石墨烯样品被氧化5秒后在473 nm激发光激发下的共聚焦荧光图像。有意地进行强激光照射从而产生光漂白现象,如位置3所示[36]
Figure 1. (A)A schematic drawing illustrating the selective binding and cellular imaging of NGO-PEG conjugated with anti-CD20 antibody(Rituxan)[31]; (B)NIR fluorescence image of CD20 positive Raji B-cells treated with the NGO-PEG-Rituxan conjugate[31]; (C)NIR fluorescence image of CD20 negative CEM T-Cells treated with NGO-PEG-Rituxan conjugate[31]; (D)Typical absorption and fluorescence emission spectra of the as-prepared GO colloid(inset:photograph for GO colloids excited by 365 nm)[34]; (E)Confocal PL image excited at 473 nm for a graphene sample oxidized for 5 s. PL at position 3 is bleached intentionally by intense laser irradiation[36]
图 3 (A) GO和介孔二氧化硅薄膜的全固态荧光源示意图[49]。(B)通过在1200 s范围内调整直流偏置电压进而得到不同的PL光谱[50]。(C)对氧化石墨烯悬浮液进行在不同曝光时间(0~180 min)光热还原处理后的荧光光谱图[51]。(D)氧化石墨烯纳米片在365 nm紫外灯照射下荧光发射图[53]
Figure 3. (A)Schematic illustration of all-solid-state PL source made of GO and mesoporous SiO2 thin film[49]. (B)DC bias dependence of normalized PL spectra tuned by application of various DC bias voltages for 1 200 s[50]. (C)Normalized PL spectra of the GO suspensions after different exposure times(0~180 min) to photothermal reduction treatment[51]. (D)Photographs of the as-prepared luminescent GO nanosheets under 365 nm UV lamp irradiations[53]
图 4 (A) 利用水热法将GO切割成GQDs的机制及其荧光光谱[59];(B)氨基功能化的GQDs的制备程序示意图及其荧光光谱图像[62]
Figure 4. (A)Mechanism for the hydrothermal cutting of GO sheets into GQDs and its photoluminescent spectra[59]; (B)schematic illustration of the preparative strategy for amino-functionalized GQDs, and the emission images as well as their photoluminescence spectra[62]
图 5 (A) GO纳米片的photo-Fenton反应原理示意图[65]; (B)碳纤维氧化切割成GQDs示意图[66]; (C)b-GQDs的合成示意图,含氧的位置有红色标记[67](彩图见电子版)
Figure 5. (A)Schematic representation of a proposed mechanism for the photo-Fenton reaction of the GO sheets[65]. (B)Representation scheme of oxidation cutting of carbon fiber into GQDs[66]. (C)Schematic illustration of the synthesis of b-GQDs. Oxygenated sites are shown in red[67](colour figures are available in electro-version)
图 6 (A) 将GQD与神经生长因子(NGF)结合的示意图[82]; (B)分子结构的GO与转铁蛋白和PEG结合的示意图[77]; (C)GO与分子染料FITC的体外双光子发光比较[76](彩图见电子版)
Figure 6. (A)Schematic illustration of conjugating a GQD with nerve growth factor(NGF)[82]; (B)a representation of the molecular structure of GO conjugated with transferrin and PEG[77]; (C)comparison of in vitro two-photon luminescence of GO with molecular dye FITC[76](color figures are available in electro-version)
-
[1] NOVOSELOV K S, GEIM A K, MOROZOV S V, et al.. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696):666-669. doi: 10.1126/science.1102896 [2] SINGH V, JOUNG D, ZHAI L, et al.. Graphene based materials:Past, present and future[J]. Prog. Mater. Sci., 2011, 56(8):1178-1271. doi: 10.1016/j.pmatsci.2011.03.003 [3] XU Y, SHI G, DUAN X. Self-assembled three-dimensional graphene macrostructures:synthesis and applications in supercapacitors[J]. Accounts Chem. Res., 2015, 48(6):1666-1675. doi: 10.1021/acs.accounts.5b00117 [4] LIU M, ZHANG R, CHEN W. Graphene-supported nanoelectrocatalysts for fuel cells:synthesis, properties, and applications[J]. Chem. Rev., 2014, 114(10):5117-5160. doi: 10.1021/cr400523y [5] BONACCORSO F, SUN Z, HASAN T, et al.. Graphene photonics and optoelectronics[J]. Nat. Photonics, 2010, 4(9):611-622. doi: 10.1038/nphoton.2010.186 [6] 李正顺, 王岩, 王雷.Fe3+对石墨烯氧化物荧光淬灭机理的研究[J].中国光学, 2016, 9(5):569-578. http://www.chineseoptics.net.cn/CN/abstract/abstract9449.shtmlLI ZH SH, WANG Y, WANG L. Fluorescence quenching mechanism of graphene oxide by Fe3+[J]. Chinese Optic, 2016, 9(5):569-578.(in Chinese) http://www.chineseoptics.net.cn/CN/abstract/abstract9449.shtml [7] 万吉祥, 陈小源, 王聪.荧光石墨烯量子点的制备及其荧光机理分析[J].功能材料, 2017, 48(8):8024-8031. http://cdmd.cnki.com.cn/Article/CDMD-10280-1014008049.htmWAN J X, CHEN X Y, WANG C. Synthesis and photoluminescence mechanism of graphene quantum dots[J]. Journal of Functional Materials, 2017, 48(8):8024-8031.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10280-1014008049.htm [8] 俞文英, 余陈欢, 方杰, 等.氧化石墨烯纳米载体的生物相容性研究进展[J].中国现代应用药学, 2017, 34(5):777-782. http://www.cnki.com.cn/Article/CJFDTotal-KXTB201420004.htmYU W Y, YU C H, FANG J, et al.. Research progress on biocompatibility of graphene oxide as a nanocarrier[J]. Chinese Journal of Modern Applied Pharmacy, 2017, 34(5):777-782.(in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-KXTB201420004.htm [9] 禚洪梅.尺寸均一的氧化石墨烯制备综述[J].轻工科技, 2017, 33(3):39-40+44. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-GNCL201010003059.htmGAO H M. Preparation of graphene oxide with uniform size[J]. Light Industry Science and Technology, 2017, 33(3):39-40+44.(in Chinese) http://cpfd.cnki.com.cn/Article/CPFDTOTAL-GNCL201010003059.htm [10] 李绍娟, 甘胜, 沐浩然.石墨烯光电子器件的应用研究进展[J].新型炭材料, 2014, 29(5):329-356. http://mall.cnki.net/magazine/Article/XTCL201405001.htmLI SH J, GAN SH, MU H R. Research progress in graphene use in photonic and optoelectronic devices[J]. New Carbon Materials, 2014, 29(5):329-356.(in Chinese) http://mall.cnki.net/magazine/Article/XTCL201405001.htm [11] STANKOVICH S, DIKIN D A, DOMMETT G H B, et al.. Graphene-based composite materials[J]. Nature, 2006, 442(7100):282-286. doi: 10.1038/nature04969 [12] KIM J, COTE L J, HUANG J X. Two dimensional soft material:new faces of graphene oxide[J]. Accounts Chem. Res., 2012, 45(8):1356-1364. doi: 10.1021/ar300047s [13] 邓尧, 黄肖容, 邬晓龄.氧化石墨烯复合材料的研究进展[J].材料导报, 2012, 26(15):84-87. doi: 10.3969/j.issn.1005-023X.2012.15.016DENG Y, HUANG X R, WU X L. Review on graphene oxide composites[J]. Materials Review, 2012, 26(15):84-87.(in Chinese) doi: 10.3969/j.issn.1005-023X.2012.15.016 [14] LI D, MULLER M B, GILJE S, et al.. Processable aqueous dispersions of graphene nanosheets[J]. Nat. Nanotechnol, 2008, 3(2):101-105. doi: 10.1038/nnano.2007.451 [15] LU C H, YANG H H, ZHU C L, et al.. A Graphene platform for sensing biomolecules[J]. Angew Chem. Int. Edit., 2009, 48(26):4785-4787. doi: 10.1002/anie.v48:26 [16] SWATHI R S, SEBASTIAN K L. Resonance energy transfer from a dye molecule to graphene[J]. Journal of Chemical Physics, 2008, 129(5):. http://cn.bing.com/academic/profile?id=cef32be6e31e0ceda6edab3ee31b6140&encoded=0&v=paper_preview&mkt=zh-cn [17] SWATHI R S, SEBASTIAN K L. Long range resonance energy transfer from a dye molecule to graphene has (distance)(-4) dependence[J]. The Journal of Chemical Physics, 2009, 130(8):086101. doi: 10.1063/1.3077292 [18] PEI H, LI J, LV M, et al.. A Graphene-based sensor array for high-precision and adaptive target identification with ensemble aptamers[J]. J. Am. Chem. Soc., 2012, 134(33):13843-13849. doi: 10.1021/ja305814u [19] DONG H F, GAO W C, YAN F, et al.. Fluorescence resonance energy transfer between quantum dots and graphene oxide for sensing biomolecules[J]. Anal. Chem., 2010, 82(13):5511-5517. doi: 10.1021/ac100852z [20] ZHANG C L, YUAN Y X, ZHANG S M, et al.. Biosensing platform based on fluorescence resonance energy transfer from upconverting nanocrystals to graphene oxide[J]. Angew Chem. Int. Edit., 2011, 50(30):6851-6854. doi: 10.1002/anie.201100769 [21] LIU X Q, WANG F, AIZEN R, et al.. Graphene oxide/nucleic-acid-stabilized silver nanoclusters:functional hybrid materials for optical aptamer sensing and multiplexed analysis of pathogenic DNAs[J]. J. Am. Chem. Soc., 2013, 135(32):11832-11839. doi: 10.1021/ja403485r [22] BALAPANURU J, YANG J X, XIAO S, et al.. A Graphene oxide-organic dye ionic complex with DNA-sensing and optical-limiting properties[J]. Angew Chem. Int. Edit., 2010, 49(37):6549-6553. doi: 10.1002/anie.201001004 [23] WEN Y, PENG C, LI D, et al.. Metal ion-modulated graphene-DNAzyme interactions:design of a nanoprobe for fluorescent detection of lead(Ⅱ) ions with high sensitivity, selectivity and tunable dynamic range[J]. Chem. Commun.(Camb), 2011, 47(22):6278-6280. doi: 10.1039/c1cc11486g [24] LIU J, WANG C, JIANG Y, et al.. Graphene signal amplification for sensitive and real-time fluorescence anisotropy detection of small molecules[J]. Anal. Chem., 2013, 85(3):1424-1430. doi: 10.1021/ac3023982 [25] JANG H, RYOO S R, KIM Y K, et al.. Discovery of HepatitisC Virus NS3 helicase inhibitors by a multiplexed, high-throughput helicase activity assay based on graphene oxide[J]. Angew Chem. Int. Edit., 2013, 52(8):2340-2344. doi: 10.1002/anie.201209222 [26] LIU B W, SUN Z Y, ZHANG X, et al.. Mechanisms of DNA sensing on graphene oxide[J]. Anal. Chem., 2013, 85(16):7987-7993. doi: 10.1021/ac401845p [27] CAO L, MEZIANI M J, SAHU S, et al.. Photoluminescence properties of graphene versus other carbon nanomaterials[J]. Accounts Chem. Res., 2013, 46(1):171-180. doi: 10.1021/ar300128j [28] HUANG H M, LI Z B, SHE J C, et al.. Oxygen density dependent band gap of reduced graphene oxide[J]. J. Appl. Phys., 2012, 111(5):. http://cn.bing.com/academic/profile?id=e208eb95478337777ad74170e72e707a&encoded=0&v=paper_preview&mkt=zh-cn [29] PAL S K. Versatile photoluminescence from graphene and its derivatives[J]. Carbon, 2015, 88:86-112. doi: 10.1016/j.carbon.2015.02.035 [30] HONG G S, LEE J C, ROBINSON J T, et al.. Multifunctional in vivo vascular imaging using near-infrared Ⅱ fluorescence[J]. Nat. Med., 2012, 18(12):1841-1846. doi: 10.1038/nm.2995 [31] SUN X M, LIU Z, WELSHER K, et al.. Nano-graphene oxide for cellular imaging and drug delivery[J]. Nano Res., 2008, 1(3):203-212. doi: 10.1007/s12274-008-8021-8 [32] ZHANG M F, OKAZAKI T, ⅡZUMI Y, et al.. Preparation of small-sized graphene oxide sheets and their biological applications[J]. J. Mater Chem. B, 2016, 4(1):121-127. doi: 10.1039/C5TB01800E [33] LUO Z T, VORA P M, MELE E J, et al.. Photoluminescence and band gap modulation in graphene oxide[J]. Appl. Phys. Lett., 2009, 94(11). http://cn.bing.com/academic/profile?id=c099499526b3e0d32b66ea6a9b8ff85e&encoded=0&v=paper_preview&mkt=zh-cn [34] CHEN J L, YAN X P. Ionic strength and pH reversible response of visible and near-infrared fluorescence of graphene oxide nanosheets for monitoring the extracellular pH[J]. Chem. Commun., 2011, 47(11):3135-3137. doi: 10.1039/c0cc03999c [35] SHANG J Z, MA L, LI J W, et al.. The origin of fluorescence from graphene oxide[J]. Sci. Rep-Uk, 2012, 2. http://cn.bing.com/academic/profile?id=489add63d5b90c3eaecf56cdf17c8226&encoded=0&v=paper_preview&mkt=zh-cn [36] GOKUS T, NAIR R R, BONETTI A, et al.. Making graphene luminescent by oxygen plasma treatment[J]. ACS Nano, 2009, 3(12):3963-3968. doi: 10.1021/nn9012753 [37] MEI Q S, ZHANG K, GUAN G J, et al.. Highly efficient photoluminescent graphene oxide with tunable surface properties[J]. Chem. Commun., 2010, 46(39):7319-7321. doi: 10.1039/c0cc02374d [38] ZHANG K, YANG L, ZHU H J, et al.. Selective visual detection of trace trinitrotoluene residues based on dual-color fluorescence of graphene oxide-nanocrystals hybrid probe[J]. Analyst, 2014, 139(10):2379-2385. doi: 10.1039/C3AN02380J [39] MEI Q S, JIANG C L, GUAN G J, et al.. Fluorescent graphene oxide logic gates for discrimination of iron(3+) and iron(2+) in living cells by imaging[J]. Chem. Commun., 2012, 48(60):7468-7470. doi: 10.1039/c2cc31992f [40] CHIEN C T, LI S S, LAI W J, et al.. Tunable photoluminescence from graphene oxide[J]. Angew Chem. Int. Edit., 2012, 51(27):6662-6666. doi: 10.1002/anie.201200474 [41] EXARHOS A L, TURK M E, KIKKAWA J M. Ultrafast spectral migration of photoluminescence in graphene oxide[J]. Nano Lett., 2013, 13(2):344-349. doi: 10.1021/nl302624p [42] MCDONALD M P, ELTOM A, VIETMEYER F, et al.. Direct observation of spatially heterogeneous single-layer graphene oxide reduction kinetics[J]. Nano Lett., 2013, 13(12):5777-5784. doi: 10.1021/nl402057j [43] EDA G, LIN Y Y, MATTEVI C, et al.. Blue photoluminescence from chemically derived graphene oxide[J]. Adv. Mater., 2010, 22(4):505. doi: 10.1002/adma.v22:4 [44] GALANDE C, MOHITE A D, NAUMOV A V, et al.. Quasi-molecular fluorescence from graphene oxide[J]. Sci. Rep-Uk, 2011, 1. http://cn.bing.com/academic/profile?id=e68de853c142a648f7bc195b6e7aee69&encoded=0&v=paper_preview&mkt=zh-cn [45] CUSHING S K, LI M, HUANG F Q, et al.. Origin of strong excitation wavelength dependent fluorescence of graphene oxide[J]. ACS Nano., 2014, 8(1):1002-1013. doi: 10.1021/nn405843d [46] THOMAS H R, VALLES C, YOUNG R J, et al.. Identifying the fluorescence of graphene oxide[J]. J. Mater. Chem. C, 2013, 1(2):338-342. doi: 10.1039/C2TC00234E [47] ROURKE J P, PANDEY P A, MOORE J J, et al.. The real graphene oxide revealed:stripping the oxidative debris from the graphene-like sheets[J]. Angew. Chem. Int. Ed., 2011, 50(14):3173-3177. doi: 10.1002/anie.201007520 [48] NAUMOV A, GROTE F, OVERGAARD M, et al.. Graphene oxide:a one-versus two-component material[J]. J. Am. Chem. Soc., 2016, 138(36):11445-11448. doi: 10.1021/jacs.6b05928 [49] TSUCHIYA T, TERABE K, AONO M. In situ and non-volatile bandgap tuning of multilayer graphene oxide in an all-solid-state electric double-layer transistor[J]. Adv. Mater., 2014, 26(7):1087-1091. doi: 10.1002/adma.201304770 [50] TSUCHIYA T, TSURUOKA T, TERABE K, et al.. In situ and nonvolatile photoluminescence tuning and nanodomain writing demonstrated by all-solid-state devices based on graphene oxide[J]. ACS Nano., 2015, 9(2):2102-2110. doi: 10.1021/nn507363g [51] CHIEN C T, LI S S, LAI W J, et al.. Tunable photoluminescence from graphene oxide[J]. Angew Chem. Int. Edit., 2012, 51(27):6662-6666. doi: 10.1002/anie.201200474 [52] MAITI R, MIDYA A, NARAYANA C, et al.. Tunable optical properties of graphene oxide by tailoring the oxygen functionalities using infrared irradiation[J]. Nanotechnology, 2014, 25(49):704. http://cn.bing.com/academic/profile?id=800c8ffe5d6603e977c6bc6183b7f5d3&encoded=0&v=paper_preview&mkt=zh-cn [53] MEI Q S, CHEN J, ZHAO J, et al.. Atomic oxygen tailored graphene oxide nanosheets emissions for multicolor cellular imaging[J]. ACS Appl. Mater Inter., 2016, 8(11):7390-7395. doi: 10.1021/acsami.6b00791 [54] GAN Z X, XIONG S J, WU X L, et al.. Mn2+-bonded reduced graphene oxide with strong radiative recombination in broad visible range caused by resonant energy transfer[J]. Nano Lett., 2011, 11(9):3951-3956. doi: 10.1021/nl202240s [55] PENG C, HU W B, ZHOU Y T, et al.. Intracellular imaging with a graphene-based fluorescent probe[J]. Small, 2010, 6(15):1686-1692. doi: 10.1002/smll.v6:15 [56] FARROW B, KAMAT P V. CdSe quantum dot sensitized solar cells. shuttling electrons through stacked carbon nanocups[J]. J. Am. Chem. Soc., 2009, 131(31):11124-11131. doi: 10.1021/ja903337c [57] LI L L, LIU K P, YANG G H, et al.. Fabrication of graphene-quantum dots composites for sensitive electrogenerated chemiluminescence immunosensing[J]. Adv. Funct. Mater., 2011, 21(5):869-878. doi: 10.1002/adfm.201001550 [58] HU S H, CHEN Y W, HUNG W T, et al.. Quantum-dot-tagged reduced graphene oxide nanocomposites for bright fluorescence bioimaging and photothermal therapy monitored in situ[J]. Adv. Mater., 2012, 24(13):1748-1754. doi: 10.1002/adma.201104070 [59] PAN D Y, ZHANG J C, LI Z, et al.. Hydrothermal route for cutting graphene sheets into blue-luminescent graphene quantum dots[J]. Adv. Mater., 2010, 22(6):734-738. doi: 10.1002/adma.v22:6 [60] KIM S, HWANG S W, KIM M K, et al.. Anomalous behaviors of visible luminescence from graphene quantum dots:interplay between size and shape[J]. ACS Nano., 2012, 6(9):8203-8208. doi: 10.1021/nn302878r [61] SUN H J, WU L, GAO N, et al.. Improvement of photoluminescence of graphene quantum dots with a biocompatible photochemical reduction pathway and its bioimaging application[J]. ACS Appl. Mater Inter., 2013, 5(3):1174-1179. doi: 10.1021/am3030849 [62] TETSUKA H, ASAHI R, NAGOYA A, et al.. Optically tunable amino-functionalized graphene quantum dots[J]. Adv. Mater., 2012, 24(39):5333-5338. doi: 10.1002/adma.201201930 [63] JIN S H, KIM D H, JUN G H, et al.. Tuning the photoluminescence of graphene quantum dots through the charge transfer effect of functional groups[J]. ACS Nano., 2013, 7(2):1239-1245. doi: 10.1021/nn304675g [64] LINGAM K, PODILA R, QIAN H J, et al.. Evidence for edge-state photoluminescence in graphene quantum dots[J]. Adv. Funct. Mater., 2013, 23(40):5062-5065. doi: 10.1002/adfm.v23.40 [65] ZHOU X J, ZHANG Y, WANG C, et al.. Photo-fenton reaction of graphene oxide:a new strategy to prepare graphene quantum dots for DNA cleavage[J]. ACS Nano., 2012, 6(8):6592-6599. doi: 10.1021/nn301629v [66] PENG J, GAO W, GUPTA B K, et al.. Graphene quantum dots derived from carbon fibers[J]. Nano Lett., 2012, 12(2):844-849. doi: 10.1021/nl2038979 [67] YE R Q, XIANG C S, LIN J, PENG Z W, et al.. Coal as an abundant source of graphene quantum dots[J]. Nat. Commun., 2013, 4. http://cn.bing.com/academic/profile?id=0dc967d711ad69a64d268f96b2ee742a&encoded=0&v=paper_preview&mkt=zh-cn [68] YE R Q, PENG Z W, METZGER A, et al.. Bandgap engineering of coal-derived graphene quantum dots[J]. ACS Appl. Mater. Inter., 2015, 7(12):7041-7048. doi: 10.1021/acsami.5b01419 [69] LI Y, HU Y, ZHAO Y, et al.. An Electrochemical avenue to green-luminescent graphene quantum dots as potential electron-acceptors for photovoltaics[J]. Adv. Mater., 2011, 23(6):776-780. doi: 10.1002/adma.201003819 [70] LIU F, JANG M H, HA H D, et al.. Facile synthetic method for pristine graphene quantum dots and graphene oxide quantum dots:origin of blue and green luminescence[J]. Adv. Mater., 2013, 25(27):3657-3662. doi: 10.1002/adma.v25.27 [71] YOON H, CHANG Y H, SONG S H, et al.. Intrinsic photoluminescence emission from subdomained graphene quantum dots[J]. Adv. Mater., 2016, 28(26):5255-5261. doi: 10.1002/adma.201600616 [72] SHEN J H, ZHU Y H, CHEN C, et al.. Facile preparation and upconversion luminescence of graphene quantum dots[J]. Chem. Commun., 2011, 47(9):2580-2582. doi: 10.1039/C0CC04812G [73] ZHU S J, ZHANG J H, TANG S J, et al.. Surface chemistry routes to modulate the photoluminescence of graphene quantum dots:from fluorescence mechanism to up-conversion bioimaging applications[J]. Adv. Funct. Mater., 2012, 22(22):4732-4740. doi: 10.1002/adfm.v22.22 [74] TAN D Z, ZHOU S F, QIU J R. Comment on "upconversion and downconversion fluorescent graphene quantum dots:ultrasonic preparation and photocatalysis"[J]. ACS Nano, 2012, 6(8):6530-6531. doi: 10.1021/nn3016822 [75] GAN Z X, WU X L, ZHOU G X, et al.. Is there real upconversion photoluminescence from graphene quantum dots[J]. Adv. Opt. Mater, 2013, 1(8):554-558. doi: 10.1002/adom.v1.8 [76] LI J L, BAO H C, HOU X L, et al.. Graphene oxide nanoparticles as a nonbleaching optical probe for two-photon luminescence imaging and cell therapy[J]. Angew Chem. Int. Edit., 2012, 51(8):1830-1834. doi: 10.1002/anie.v51.8 [77] QIAN J, WANG D, CAI F H, et al.. Observation of multiphoton-induced fluorescence from graphene oxide nanoparticles and applications in in vivo functional bioimaging[J]. Angew Chem. Int. Edit., 2012, 51(42):10570-10575. doi: 10.1002/anie.201206107 [78] LIU Q, GUO B D, RAO Z Y, et al.. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging[J]. Nano Lett., 2013, 13(6):2436-2441. doi: 10.1021/nl400368v [79] NAHAIN A A, LEE E J, JEONG H J. Photoresponsive fluorescent reduced graphene oxide by spiropyran conjugated hyaluronic acid for in vivo imaging and target delivery[J]. Biomacromolecules, 2013, 14:4082. doi: 10.1021/bm4012166 [80] NAHAIN A A, LEE J E, IN I. Target delivery and cell imaging using hyaluronic acid-functionalized graphene quantum dots[J]. Mol. Pharmaceutics, 2013, 10:3736. doi: 10.1021/mp400219u [81] GE J, LAN M, ZHOU B. A graphene quantum dot photodynamic therapy agent with high singlet oxygen generation[J]. Nat. Commun., 2014, 5:4596. doi: 10.1038/ncomms5596 [82] ZHENG T X, THAN A, ANANTHANARAYA A. Graphene quantum dots as universal fluorophores and their use in revealing regulated trafficking of insulin receptors in adipocytes[J]. ACS Nano, 2013, 7:6278. doi: 10.1021/nn4023137 -






 下载:
下载: