Surface functional microstructure of biomedical materials prepared by ultrafast laser: a review
-
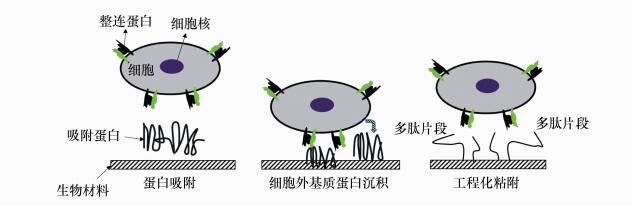
摘要: 提高医疗植入材料的生物相容性,对提升植入医疗器械的安全性有重要意义。通过超快激光制造出微纳米级别尺寸的材料结构以改善材料的生物相容性,近年来已被广泛应用于生物医学领域。本文简单介绍了细胞与生物材料相互作用原理,从生物材料表面微结构对其生物相容性能的影响出发,综述了超快激光加工不同材料表面形貌特征对细胞粘附、迁移、增殖、分化的影响,并进一步指出超快激光制备微纳结构在生物材料领域的局限和发展趋势。Abstract: Improvements to the biocompatibility of medical implant biomaterials have a great significant impact toward improving the safety of the implants. Ultrafast lasers have been widely used in biomedical sciences for their ability to produce micro/nano structures that improve the biocompatibility of biomaterials. In this paper, mechanisms of interaction between cell and biomaterials are briefly introduced. The effects of surface topography on cell adhesion, migration, multiplication and differentiation are summarized according to the effect of surface structure on the biocompatibility. The disadvantages of current laser microfabrication technologies in biomaterials are identified and suggestions for further development are provided.
-
Key words:
- biomaterials /
- ultrafast laser /
- micro/nano-structures /
- cell behavior
-
图 4 未经处理的硅片以及经过不同能量密度的飞秒激光处理的硅片表面微观形貌图(a)和在与(a)对应表面上,纤维细胞生长72 h之后的荧光显微图像(b)
Figure 4. Microstructure topography of untreated Si wafers and wafers treated by femtosecond lasers with different energy densities(a) and fluorescence microscoy images(b) of fiber cells after 72 hours of growth on the corresponding surface (a)
图 6 (a) SW10细胞培养在:(ⅰ)未处理硅表面,(ⅱ)~(ⅴ)不同激光能量密度加工表面的细胞荧光图;(b)培养3天后,SW10细胞在不同表面的数量
Figure 6. (a)Fluorescence microscopy images of SW10 cells cultured on untreated Si(ⅰ), patterned Si substrates fabricated at different laser desities(ⅱ-ⅴ). (b)Number of SW10 cells growing on the laser-patterned Si substrates for 3 days of culture(DOC)
图 8 OLN细胞在(a)未处理表面;(b)不同高度气泡结构表面; (c)高度200 nm的汽泡结构表面和(d)高度3 μm汽泡结构表面的细胞迁移。黑色箭头显示了细胞在最初的12 h内具有良好的方向性
Figure 8. Optical microscopy images of OLN cells cultured on (a)unstructured control chitosan surface, on (b)bubbles like structures array, and with bubble height of 200 nm(c) and 3μm(d). Black arrows indicate the cell directionality encouraged in its early stages(first 12 h) on CS structures
图 9 (a) 激光(532 nm)在200 nm聚苯乙烯薄膜上制备的周期为25 μm,深度分别为<4 μm、4~6 μm和>7 μm的沟槽结构;(b)平滑肌细胞培养在对应结构上的荧光图
Figure 9. (a)Groove structures with period of 25 μm and depth less than 4 μm, during in 4-6 μm, more than 7 μm, prepared by 532 nm laser on 200 nm polystyrene film; (b)fluorescence images of smooth muscle cells cultured on the groove structures
图 11 细胞培养4周后,(a)细胞在未处理表面、LIPSS、NP和MC-LIPSS细胞荧光图;(b)细胞培养在XO和OI中的荧光图;不同基体的荧光强度:XO(c)和OI(d)
Figure 11. (a)Fluorescence images of cell culture after 4 weeks, from left to right are for polished surface, laser-induced periodic surface structures, NP and microcolumn surfaces. (b)Fluorescence images of cells are cultured in XO and OI. Fluorescence intensities of XO(c) and OI(d). XO:Xylenol orange; OI:Osteo image
图 12 (a) 培养1天和3天后,肌成纤维细胞在不同基体上的密度;(b)肌成纤维细胞中等密度结构上生长出伪足;(c)肌成纤维细胞在未处理表面有大量伪足;(d)图(c)伪足结束部位的放大图
Figure 12. (a)Myofibroblast [45] cell densities on the different substrates when cell cultured after one day and three days. (b)Myofibroblasts without filopodia growing on MD. (c)Myofibroblasts with extensive filopodia on non-treated steel. (d)Extract from (c): Detailed view on flattened regions at the filopodia endings(arrowheads). Non-treated, Low Density, Medium Density(MD) and High Density samples
表 1 微细加工生物材料方法对比
Table 1. Comparison of main advantages and disadvantages of micromachining processes
-
[1] MULLIN R. Exelixis restructures:BIOTECH:cancer drug firm shifts resources to development and cuts 40% of jobs[J]. Chemical & Engineering News, 2010, 88(11):12. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0222121237/ [2] VALIULIS A V. The advanced structural materials for living beings implants[J]. Journal of Vibroengineering, 2007, 9(4):64-72. [3] CRAWFORD G H. The role of patch testing in the evaluation of orthopedic implant-related adverse effects:current evidence does not support broad use[J]. Dermatitis, 2013, 24(3):99-103. doi: 10.1097/DER.0b013e3182948251 [4] KZHYSHKOWSKA J, GUDIMA A, RIABOV V, et al.. Macrophage responses to implants:prospects for personalized medicine[J]. Journal of Leukocyte Biology, 2015, 98(6):953-962. doi: 10.1189/jlb.5VMR0415-166R [5] VELNAR T, BUNC G, KLOBUCAR R, et al.. Biomaterials and host versus graft response:a short review[J]. Bosnian Journal of Basic Medical Sciences, 2016, 16(2):82-90. [6] 刘存平, 刘勇, 赖啸.材料的生物相容性评价方法和发展趋势[J].科技风, 2016(1):23. doi: 10.3969/j.issn.1671-7341.2016.01.020LIU C P, LIU Y, LAI X. Evaluated methods and developmental trend of biocompatibility of biomaterials[J]. Technology Wind, 2016(1):23.(in Chinese) doi: 10.3969/j.issn.1671-7341.2016.01.020 [7] MUSKOVICH M, BETTINGER C J. Biomaterials-based electronics:polymers and interfaces for biology and medicine[J]. Advanced Healthcare Materials, 2012, 1(3):248-266. doi: 10.1002/adhm.201200071 [8] GHADIALLY R. Epidermal stem cells[J]. Advances in Dermatology, 2005, 21:335-355. doi: 10.1016/j.yadr.2005.04.003 [9] CURRAN J M, CHEN R, HUNT J A. Controlling the phenotype and function of mesenchymal stem cells in vitro by adhesion to silane-modified clean glass surfaces[J]. Biomaterials, 2005, 26(34):7057-7067. doi: 10.1016/j.biomaterials.2005.05.008 [10] 彭荣.高分子表面微图案技术研究干细胞形状、尺寸和密度对其分化的影响[D].上海: 复旦大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10246-1013103068.htmPENG R. Effects of cell shape, spreading size and cell density on differentiation of stem cells on micropatterned surfaces of a polymeric hydrogel[D]. Shanghai: Fudan University, 2012.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10246-1013103068.htm [11] HARRISON R G. The cultivation of tissues in extraneous media as a method of morpho-genetic study[J]. The Anatomical Record, 1912, 6(4):181-193. doi: 10.1002/(ISSN)1097-0185 [12] BRUNETTE D M, TENGVALL P, TEXTOR M, et al.. Titanium in Medicine:Material Science, Surface Science, Engineering, Biological Responses, and Medical Applications[M]. New York:Springer, 2001. [13] CUNHA A, ZOUANI O F, PLAWINSKI L, et al.. Human mesenchymal stem cell behavior on femtosecond laser-textured Ti-6Al-4V surfaces[J]. Nanomedicine, 2015, 10(5):725-739. doi: 10.2217/nnm.15.19 [14] DASKALOVA A, TRIFONOV A, BLIZNAKOVA I, et al.. Selective cell response on natural polymer bio-interfaces textured by femtosecond laser[J]. Applied Physics A, 2018, 124(2):207. doi: 10.1007/s00339-018-1628-z [15] ULMEANU M, SIMA L E, URSESCU D, et al.. Cell adhesion response on femtosecond laser initiated liquid assisted silicon surface[J]. Current Topics in Medicinal Chemistry, 2014, 14(5):624-629. doi: 10.2174/1568026614666140118204946 [16] YAO X, PENG R, DING J D. Cell-material interactions revealed via material techniques of surface patterning[J]. Advanced Materials, 2013, 25(37):5257-5286. doi: 10.1002/adma.201301762 [17] WATT F M, HUCK W T S. Role of the extracellular matrix in regulating stem cell fate[J]. Nature Reviews Molecular Cell Biology, 2013, 14(8):467-473. doi: 10.1038/nrm3620 [18] 孟维艳.纯钛表面微米-纳米微结构的构建及生物学研究[D].长春: 吉林大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10183-2011014697.htmMENG W Y. The biological study and construction of micro-nano titanium surface[D]. Changchun: Jilin University, 2010.(in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10183-2011014697.htm [19] 沈新坤.医用钛/钛合金表面生物功能化及生物响应[D].重庆: 重庆大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10611-1017801863.htmSHEN X K. Surface biofunctionalization of biomedical titanium/titanium alloy and biological responses[D]. Chongqing: Chongqing University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10611-1017801863.htm [20] GARCIA A J, REYES C D. Bio-adhesive surfaces to promote osteoblast differentiation and bone formation[J]. Journal of Dental Research, 2005, 84(5):407-413. doi: 10.1177/154405910508400502 [21] SAFRAN S A, BESSER A, NICOLAS A. Self assembly and dynamics of protein adsorption to cell adhesions[C]. Proceedings of the 231st National Meeting of the American-Chemical-Society, MAR, 2006: 26-30. [22] 杨恬, 易静, 陈誉华, 等.医学细胞生物学:基础、进展和趋势[M].北京:人民卫生出版社, 2011.YANG T, YI J, CHEN Y H, et al.. Medical Cell Biology:Foundation, Progress and Trend[M]. Beijing:People's Medical Publishing House, 2011.(in Chinese) [23] EISENBARTH E, LINEZ P, BIEHL V, et al.. Cell orientation and cytoskeleton organisation on ground titanium surfaces[J]. Biomolecular Engineering, 2002, 19:233-237. doi: 10.1016/S1389-0344(02)00028-X [24] PHILLIPS K C, GANDHI H H, MAZUR E, et al.. Ultrafast laser processing of materials:a review[J]. Advances in Optics and Photonic, 2015, 7(4):684-712. doi: 10.1364/AOP.7.000684 [25] ZUHLKE C A, ANDERSON T P, ALEXANDER D R. Formation of multiscale surface structures on nickel via above surface growth and below surface growth mechanisms using femtosecond laser pulses[J]. Optics Express, 2013, 21(7):8460-8473. doi: 10.1364/OE.21.008460 [26] CZYZ K, MARCZAK J, MAJOR R, et al.. Selected laser methods for surface structuring of biocompatible diamond-like carbon layers[J]. Diamond and Related Materials, 2016, 67:26-40. doi: 10.1016/j.diamond.2016.01.013 [27] VOROBYEV A Y, GUO CH L. Femtosecond laser surface structuring of biocompatible metals[J]. Proceedings of SPIE, 2009, 7203:72030O. doi: 10.1117/12.809593 [28] AHMMED K M T, GRAMBOW C, KIETZIG A M. Fabrication of micro/nano structures on metals by femtosecond laser micromachining[J]. Micromachines, 2014, 5(4):1219-1253. doi: 10.3390/mi5041219 [29] CHILLMAN A, RAMULU M, HASHISH M. Waterjet peening and surface preparation at 600 MPa:a preliminary experimental study[J]. Journal of Fluids Engineering, 2006, 129(4):485-490. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0212679946/ [30] KUMAR A, HIREMATH S S. Improvement of geometrical accuracy of micro holes machined through micro abrasive jet machining[J]. Procedia CIRP, 2016, 46:47-50. doi: 10.1016/j.procir.2016.03.139 [31] KONG M C, AXINTE D, VOICE W. Challenges in using waterjet machining of NiTi shape memory alloys:an analysis of controlled-depth milling[J]. Journal of Materials Processing Technology, 2011, 211(6):959-971. doi: 10.1016/j.jmatprotec.2010.12.015 [32] GRINSPAN A S, GNANAMOORTHY R. A novel surface modification technique for the introduction of compressive residual stress and preliminary studies on Al alloy AA6063[J]. Surface and Coatings Technology, 2006, 201(3-4):1768-1775. doi: 10.1016/j.surfcoat.2006.03.002 [33] SINGH R, KHAMBA J S. Ultrasonic machining of titanium and its alloys:a review[J]. Journal of Materials Processing Technology, 2006, 173(2):125-135. doi: 10.1016/j.jmatprotec.2005.10.027 [34] XIAO X ZH, ZHENG K, LIAO W H. Theoretical model for cutting force in rotary ultrasonic milling of dental zirconia ceramics[J]. The International Journal of Advanced Manufacturing Technology, 2014, 75(9-12):1263-1277. doi: 10.1007/s00170-014-6216-6 [35] RAUTRAY T R, NARAYAN R, KIM K H. Ion implantation of titanium based biomaterials[J]. Progress in Materials Science, 2011, 56(8):1137-1177. doi: 10.1016/j.pmatsci.2011.03.002 [36] KLOCKE F, SCHWADE M, KLINK A, et al.. Influence of electro discharge machining of biodegradable magnesium on the biocompatibility[J]. Procedia CIRP, 2013, 5:88-93. doi: 10.1016/j.procir.2013.01.018 [37] NTASI A, MUELLER W D, ELIADES G, et al.. The effect of Electro Discharge Machining(EDM) on the corrosion resistance of dental alloys[J]. Dental Materials, 2010, 26(12):e237-e245. doi: 10.1016/j.dental.2010.08.001 [38] PARK H W, LEE I. Large pulsed electron beam surface treatment of translucent PMMA[J]. Applied Surface Science, 2014, 308:311-315. doi: 10.1016/j.apsusc.2014.04.163 [39] KIM J, LEE W J, PARK H W. The state of the art in the electron beam manufacturing processes[J]. International Journal of Precision Engineering and Manufacturing, 2016, 17(11):1575-1585. doi: 10.1007/s12541-016-0184-8 [40] BAE H, CHU H H, EDALAT F, et al.. Development of functional biomaterials with micro-and nanoscale technologies for tissue engineering and drug delivery applications[J]. Journal of Tissue Engineering and Regenerative Medicine, 2014, 8(1):1-14. [41] DUBEY A K, YADAVA V. Laser beam machining-A review[J]. International Journal of Machine Tools and Manufacture, 2008, 48(6):609-628. doi: 10.1016/j.ijmachtools.2007.10.017 [42] MEIJER J. Laser beam machining(LBM), state of the art and new opportunities[J]. Journal of Materials Processing Technology, 2004, 149(1):2-17. [43] DING K, YE L. Simulation of multiple laser shock peening of a 35CD4 steel alloy[J]. Journal of Materials Processing Technology, 2006, 178(1-3):162-169. doi: 10.1016/j.jmatprotec.2006.03.170 [44] YOU M H, KWAK M K, KIM D H, et al.. Synergistically enhanced osteogenic differentiation of human mesenchymal stem cells by culture on nanostructured surfaces with induction media[J]. Biomacromolecules, 2010, 11(7):1856-1862. doi: 10.1021/bm100374n [45] HU Y, CAI K Y, LUO ZH, et al.. Surface mediated in situ differentiation of mesenchymal stem cells on gene-functionalized titanium films fabricated by layer-by-layer technique[J]. Biomaterials, 2009, 30(21):3626-3635. doi: 10.1016/j.biomaterials.2009.03.037 [46] MEYER U, BUCHTER A, WIESMANN H P, et al.. Basic reactions of osteoblasts on structured material surfaces[J]. European Cells and Materials, 2005, 9:39-49. http://d.old.wanfangdata.com.cn/OAPaper/oai_doaj-articles_84298179c92eee7e86d99921d3070b35 [47] HALLGREN C, REIMERS H, CHAKAROV D, et al.. An in vivo study of bone response to implants topographically modified by laser micromachining[J]. Biomaterials, 2003, 24(5):701-710. doi: 10.1016/S0142-9612(02)00266-1 [48] RANELLA A, BARBEROGLOU M, BAKOGIANNI S, et al.. Tuning cell adhesion by controlling the roughness and wettability of 3D micro/nano silicon structures[J]. Acta Biomaterialia, 2010, 6(7):2711-2720. doi: 10.1016/j.actbio.2010.01.016 [49] NUUTINEN T, SILVENNOINEN M, PAIVASAARI K, et al.. Control of cultured human cells with femtosecond laser ablated patterns on steel and plastic surfaces[J]. Biomedical Microdevices, 2013, 15(2):279-288. doi: 10.1007/s10544-012-9726-8 [50] NAKAMURA K, KEATING J H, EDELMAN E R. Pathology of endovascular stents[J]. Interventional Cardiology Clinics, 2016, 5(3):391-403. doi: 10.1016/j.iccl.2016.02.006 [51] MCDANIEL C, GLADKOVSKAYA O, FLANAGAN A, et al.. In vitro study on the response of RAW264.7 and MS-5 fibroblast cells on laser-induced periodic surface structures for stainless steel alloys[J]. RSC Advances, 2015, 5(53):42548-42558. doi: 10.1039/C5RA04342E [52] WANG X F, OHLIN C A, LU Q H, et al.. Influence of physicochemical properties of laser-modified polystyrene on bovine serum albumin adsorption and rat C6 glioma cell behavior[J]. Journal of Biomedical Materials Research Part A, 2006, 78A(4):746-754. doi: 10.1002/(ISSN)1552-4965 [53] YIANNAKOU C, SIMITZI C, MANOUSAKI A, et al.. Cell patterning via laser micro/nano structured silicon surfaces[J]. Biofabrication, 2017, 9(2):025024. doi: 10.1088/1758-5090/aa71c6 [54] NGUYEN A T, SATHE S R, YIM E K F. From nano to micro:topographical scale and its impact on cell adhesion, morphology and contact guidance[J]. Journal of Physics:Condensed Matter, 2016, 28(18):183001. doi: 10.1088/0953-8984/28/18/183001 [55] WALLAT K, DÖRR D, LE HARZIC R, et al.. Cellular reactions toward nanostructured silicon surfaces created by laser ablation[J]. Journal of Laser Applications, 2012, 24(4):042016. doi: 10.2351/1.4732594 [56] YANG M, LIM C C, LIAO R L, et al.. Oriented and vectorial patterning of cardiac myocytes using a microfluidic dielectrophoresis chip-towards engineered cardiac tissue with controlled macroscopic anisotropy[J]. Journal of Microelectromechanical Systems, 2006, 15(6):1483-1491. doi: 10.1109/JMEMS.2006.883530 [57] STEPAK B D, LECKA K M, PLONEK T, et al.. Laser induced periodic surface structures on pyrolytic carbon prosthetic heart valve[J]. Proceedings of SPIE, 2016, 10159:101590J. [58] RUSEN L, CAZAN M, MUSTACIOSU C, et al.. Tailored topography control of biopolymer surfaces by ultrafast lasers for cell substrate studies[J]. Applied Surface Science, 2014, 302:256-261. doi: 10.1016/j.apsusc.2013.10.023 [59] 郑庭.钛系材料微纳结构表面成骨细胞及胶原蛋白吸附机理研究[D].哈尔滨: 哈尔滨工业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10213-1017862359.htmZHENG T. Adsrotpion mechanism of osteoblasts and collagen on micro-/nano-structured Ti-material surface[D]. Harbin: Harbin Institute of Technology, 2017.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10213-1017862359.htm [60] ERDOGAN M, ÖKTEM B, KALAYCIOGLU H, et al.. Texturing of titanium(Ti6Al4V) medical implant surfaces with MHz-repetition-rate femtosecond and picosecond Yb-doped fiber lasers[J]. Optics Express, 2011, 19(11):10986-10996. doi: 10.1364/OE.19.010986 [61] SCHLIE S, FADEEVA E, KOCH J, et al.. Femtosecond laser fabricated spike structures for selective control of cellular behavior[J]. Journal of Biomaterials Applications, 2010, 25(3):217-233. doi: 10.1177/0885328209345553 [62] WANG Y, JIANG X L, YANG S CH, et al.. MicroRNAs in the regulation of interfacial behaviors of MSCs cultured on microgrooved surface pattern[J]. Biomaterials, 2011, 32(35):9207-9217. doi: 10.1016/j.biomaterials.2011.08.058 [63] WATARI S, HAYASHI K, WOOD J A, et al.. Modulation of osteogenic differentiation in hMSCs cells by submicron topographically-patterned ridges and grooves[J]. Biomaterials, 2012, 33(1):128-136. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3208761 [64] DUMAS V, GUIGNANDON A, VICO L, et al.. Femtosecond laser nano/micro patterning of titanium influences mesenchymal stem cell adhesion and commitment[J]. Biomedical Materials, 2015, 10(5):055002. doi: 10.1088/1748-6041/10/5/055002 [65] SHALABI M M, GORTEMAKER A, HOF M A V, et al.. Implant surface roughness and bone healing:a systematic review[J]. Journal of Dental Research, 2006, 85(6):496-500. doi: 10.1177/154405910608500603 [66] BECKER J, KIRSCH A, SCHWARZ F, et al.. Bone apposition to titanium implants biocoated with recombinant human bone morphogenetic protein-2(rhBMP-2). A pilot study in dogs[J]. Clinical Oral Investigations, 2006, 10(3):217-224. doi: 10.1007/s00784-006-0049-0 [67] 杨菁.纳米控释系统的制备及在血管再狭窄和肿瘤治疗中的应用[D].北京: 北京协和医学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10023-1013311834.htmYANG J. Preparation of nano controlled release system and its application in restenosis and tumor therapy[D]. Beijing: Peking Union Medical College, 2013.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10023-1013311834.htm [68] OBERRINGER M, AKMAN E, LEE J, et al.. Reduced myofibroblast differentiation on femtosecond laser treated 316LS stainless steel[J]. Materials Science and Engineering:C, 2013, 33(2):901-908. doi: 10.1016/j.msec.2012.11.018 [69] LEE M R, KWON K W, JUNG H, et al.. Direct differentiation of human embryonic stem cells into selective neurons on nanoscale ridge/groove pattern arrays[J]. Biomaterials, 2010, 31(15):4360-4366. doi: 10.1016/j.biomaterials.2010.02.012 [70] YIM E K F, PANG S W, LEONG K W. Synthetic nanostructures inducing differentiation of human mesenchymal stem cells into neuronal lineage[J]. Experimental Cell Research, 2007, 313(9):1820-1829. doi: 10.1016/j.yexcr.2007.02.031 [71] VEDULA S R K, RAVASIO A, ANON E, et al.. Microfabricated Environments to Study Collective Cell Behaviors[M]. Micropatterning in Cell Biology Part B. Amsterdam: Academic Press, 2014. -






 下载:
下载: