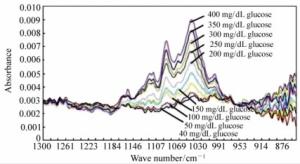
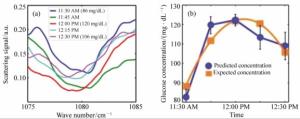
-
摘要: 连续监测血糖浓度是控制糖尿病及其并发症的前提,无创伤性血糖浓度检测方法备受关注。近几十年来,随着测量精度的不断提高,基于光学的无创伤性血糖浓度检测方法呈现出巨大发展潜力,有望在未来实现临床应用。本文详细介绍了偏振光旋光法、光学相干断层成像法、红外光谱法等主流光学无创血糖检测方法,重点对其基本原理、测量优势、测量精度、存在问题与可能解决方法等进行了综述和分析,对比发现红外光谱法在测量精度方面具有明显优势。最后指出未来还需从提高仪器信噪比、消除背景干扰以及建立更加普适的校正模型等方面展开研究。Abstract: Continuous monitoring of blood glucose levels is a prerequisite for controlling diabetes and its complications. Noninvasive methods have attracted great attention for their lack of injury and widespread acceptance. With the improvement of measurement accuracy in recent decades, optics-based methods of noninvasive blood glucose detection have shown great potential in clinical applications. In this paper, the main optics-based methods of noninvasive blood glucose detection, such as polarimetry, optical coherence tomography and infrared spectroscopy, are reviewed with regards to their principles, advantages, accuracy, problems and the possible solutions to those problems. By comparison, it concludes that the method of infrared spectroscopy has obvious advantages in detection accuracy. In the future, major challenges will be in increasing the signal-to-noise ratio of instruments, eliminating background interference and establishing universal calibration models.
-
表 1 光学无创血糖浓度检测的精度
Table 1. The accuracies of optical methods for noninvasive blood glucose detection
SEP:mg/dL Optical methods Glucosesolution Bloodserum Blood plasma Livingrabbit/pig Humansubject Polarimetry Stationary:4.30[35] 20.63(SD)[32] — 11.66(MARD)[30] — Moving:13.50[35] OCT — — — 17.00[10]Note1 8.21(RMSE)[38] NIR spectroscopy 8.10[48] 9.00[47] 20.38[49] — 10.00(RMSE)[78] Mid-IR spectroscopy 3.50(RMSE)[17] 7.38(SD)[79] 17.10[80] — 9.60[81] Raman spectroscopy 20.71(SD)[18] — — — 7.80%±1.80%[19]Note2 Photoacoustic spectroscopy 12.14(RMSE)[82] — — — 10.97(RMSE)[83] Note 1:Minimum prediction uncertainty is 17.00 mg/dL; Note 2:MAE of blood glucose is 7.8%±1.8%. -
[1] CHO N H. IDF diabetes atlas(eighth edition2017)[EB/OL].[2018-08-06]. https://www.idf.org/e-library/welcome.html. [2] DANAEI G, FINUCANE M M, LU Y, et al..National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980:systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants[J]. The Lancet, 2011, 378(9785):31-40. doi: 10.1016/S0140-6736(11)60679-X [3] 陈玮, 陈裕泉.非图案化法制备柔性连续葡萄糖监测传感器[J].分析化学, 2016, 44(4):654-659. http://d.old.wanfangdata.com.cn/Periodical/fxhx201604022CHEN W, CHEN Y Q. Fabrication of flexible continuous glucose monitoring sensor by non-patterning method[J]. Chinese Journal of Analytical Chemistry, 2016, 44(4):654-659.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201604022 [4] 范一强, 高峰, 王玫, 等.可穿戴式微流控芯片在体液检测和药物递送中的研究进展[J].分析化学, 2017, 45(3):455-463. http://d.old.wanfangdata.com.cn/Periodical/fxhx201703027FAN Y Q, GAO F, WANG M, et al.. Recent development of wearable microfluidics applied in body fluid testing and drug delivery[J]. Chinese Journal of Analytical Chemistry, 2017, 45(3):455-463.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201703027 [5] LIU J, JIANG L Y, LIU H M, et al.. A bifunctional biosensor for subcutaneous glucose monitoring by reverse iontophoresis[J]. Journal of Electroanalytical Chemistry, 2011, 660(1):8-13. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=8ebe76ec73eba14fc592f64beca3a4d0 [6] PLEITEZ M, VON LILIENFELD-TOAL H, MÄNTELE W. Infrared spectroscopic analysis of human interstitial fluid in vitro and in vivo using FT-IR spectroscopy and pulsed quantum cascade lasers(QCL):establishing a new approach to non invasive glucose measurement[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2012, 85(1):61-65. doi: 10.1016/j.saa.2011.09.007 [7] BABA J S, CAMERON B D, COTE G L. Effect of temperature, pH, and corneal birefringence on polarimetric glucose monitoring in the eye[J]. Journal of Biomedical Optics, 2002, 7(3):321-328. doi: 10.1117/1.1484163 [8] CAMERON B D, GORDE H W, SATHEESAN B, et al.. The use of polarized laser light through the eye for noninvasive glucose monitoring[J]. Diabetes Technology & Therapeutics, 1999, 1(2):135-143. http://cn.bing.com/academic/profile?id=37b485c98ed97b68473c03c9cab0d79c&encoded=0&v=paper_preview&mkt=zh-cn [9] LARIN K V, ELEDRISI M S, MOTAMEDI M, et al.. Noninvasive blood glucose monitoring with optical coherence tomography:a pilot study in human subjects[J]. Diabetes Care, 2002, 25(12):2263-2267. doi: 10.2337/diacare.25.12.2263 [10] KURANOV R V, SAPOZHNIKOVA V V, PROUGH D S, et al..Prediction capability of optical coherence tomography for blood glucose concentration monitoring[J]. Journal of Diabetes Science and Technology, 2007, 1(4):470-477. doi: 10.1177/193229680700100404 [11] LARIN K V, MOTAMEDI M, ASHITKOV T V, et al.. Specificity of noninvasive blood glucose sensing using optical coherence tomography technique:a pilot study[J]. Physics in Medicine and Biology, 2003, 48(10):1371-1390. doi: 10.1088/0031-9155/48/10/310 [12] HE R Y, WEI H J, GU H M, et al.. Effects of optical clearing agents on noninvasive blood glucose monitoring with optical coherence tomography:a pilot study[J]. Journal of Biomedical Optics, 2012, 17(10):101513. doi: 10.1117/1.JBO.17.10.101513 [13] MARUO K, OOTA T, TSURUGI M, et al.. Noninvasive near-infrared blood glucose monitoring using a calibration model built by a numerical simulation method:trial application to patients in an intensive care unit[J]. Applied Spectroscopy, 2006, 60(12):1423-1431. doi: 10.1366/000370206779321508 [14] RAMASAHAYAM S, ARORA L, CHOWDHURY S R, et al.. FPGA based system for blood glucose sensing using photoplethysmography and online motion artifact correction using adaline[C]. Proceedings of the 9th International Conference on Sensing Technology, IEEE, 2015. [15] MENDELSON Y, CLERMONT A C, PEURA R A, et al..Blood glucose measurement by multiple attenuated total reflection and infrared absorption spectroscopy[J]. IEEE Transactions on Biomedical Engineering, 1990, 37(5):458-465. doi: 10.1109/10.55636 [16] MEINKE M, MÜLLER G J, ALBRECHT H, et al.. Two-wavelength carbon dioxide laser application for in-vitro blood glucose measurements[J]. Journal of Biomedical Optics, 2008, 13(1):014021. doi: 10.1117/1.2870093 [17] YU S L, LI D C, CHONG H, et al.. Continuous glucose determination using fiber-based tunable mid-infrared laser spectroscopy[J]. Optics and Lasers in Engineering, 2014, 55:78-83. doi: 10.1016/j.optlaseng.2013.10.016 [18] GOETZ M J, COTÉ G L, ERCKENS R, et al.. Application of a multivariate technique to Raman spectra for quantification of body chemicals[J]. IEEE Transactions on Biomedical Engineering, 1995, 42(7):728-731. doi: 10.1109/10.391172 [19] ENEJDER A M K, SCECINA T G, OH J, et al..Raman spectroscopy for noninvasive glucose measurements[J]. Journal of Biomedical Optics, 2005, 10(3):031114. doi: 10.1117/1.1920212 [20] RUSSELL R J, PISHKO M V, GEFRIDES C C, et al.. A fluorescence-based glucose biosensor using concanavalin a and dextran encapsulated in a poly(ethylene glycol) hydrogel[J]. Analytical Chemistry, 1999, 71(15):3126-3132. doi: 10.1021/ac990060r [21] BALLERSTADT R, EVANS C, GOWDA A, et al.. In vivo performance evaluation of a transdermal near-infrared fluorescence resonance energy transfer affinity sensor for continuous glucose monitoring[J]. Diabetes Technology & Therapeutics, 2006, 8(3):296-311. doi: 10.1089/dia.2006.8.296 [22] REN ZH, LIU G D, HUANG ZH. Determination of glucose concentration based on pulsed laser induced photoacoustic technique and least square fitting algorithm[J]. Proceedings of SPIE, 2015, 9619:96190M. doi: 10.1117/12.2190601 [23] ALAROUSU E, HAST J T, KINNUNEN M T, et al..Noninvasive glucose sensing in scattering media using OCT, PAS, and TOF techniques[J]. Proceedings of SPIE, 2004, 5474:33-41. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=CC026704761 [24] 陶曾, 王敏.基于超声调制光信号技术无创检查葡萄糖浓度[J].科技资讯, 2014, 12(11):20-21. doi: 10.3969/j.issn.1672-3791.2014.11.014TAO Z, WANG M. Noninvasive detection of glucose concentration based on ultrasound-modulated light signal technology[J]. Science & Technology Information, 2014, 12(11):20-21.(in Chinese) doi: 10.3969/j.issn.1672-3791.2014.11.014 [25] SRIVASTAVA A, CHOWDHURY M K, SHARMA S, et al.. Measurement of glucose by using modulating ultrasound with optical technique in normal and diabetic human blood serum[C]. Proceedings of 2014 IEEE International Conference on Advances in Engineering & Technology Research, IEEE, 2014. [26] CHOWDHURY M K, SRIVASTAVA A, SHARMA N, et al..Noninvasive blood glucose measurement utilizing a newly designed system based on modulated ultrasound and infrared light[J]. International Journal of Diabetes in Developing Countries, 2016, 36(4):439-448. doi: 10.1007/s13410-015-0459-0 [27] MARCH W, ENGERMAN R, RABINOVITCH B. Optical monitor of glucose[J]. Transactions-American Society for Artificial Internal Organs, 1979, 25(1):28-31. doi: 10.1097/00002480-197902500-00006 [28] CHOU CH E, HAN CH Y, KUO W CH, et al..Noninvasive glucose monitoring in vivo with an optical heterodyne polarimeter[J]. Applied Optics, 1998, 37(16):3553-3557. doi: 10.1364/AO.37.003553 [29] CAMERON B D, BABA J S, COTÉ G L. Measurement of the glucose transport time delay between the blood and aqueous humor of the eye for the eventual development of a noninvasive glucose sensor[J]. Diabetes Technology & Therapeutics, 2001, 3(2):201-207. http://cn.bing.com/academic/profile?id=38351d7ab01be0a0d32d45f962355567&encoded=0&v=paper_preview&mkt=zh-cn [30] PIRNSTILL C W, MALIK B H, GRESHAM V C, et al.. In vivo glucose monitoring using dual-wavelength polarimetry to overcome corneal birefringence in the presence of motion[J]. Diabetes Technology & Therapeutics, 2012, 14(9):819-827. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=b001418e882a5c2684b11a559c6c7694 [31] WAN Q J. Dual-wavelength polarimetry for monitoring glucose in the presence of varying birefringence[D]. College Station: Texas A&M University, 2005. [32] 王洪.基于偏振光原理的无创血糖测量技术及其实验研究[D].重庆: 第三军医大学, 2009.WANG H. Non-invasive blood glucose measurement techniques based on the principle of polarized light and its experimental study[D]. Chongqing: Third Military Medical University, 2009.(in Chinese) [33] MALIK B H, COTÉ G L. Real-time, closed-loop dual-wavelength optical polarimetry for glucose monitoring[J]. Journal of Biomedical Optics, 2010, 15(1):017002. doi: 10.1117/1.3290819 [34] GRUNDEN D T, PIRNSTILL C W, COTÉ G L. High-speed dual-wavelength optical polarimetry for glucose sensing[J]. Proceedings of SPIE, 2014, 8951:895111. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=CC0214510501 [35] 余振芳.光学无创血糖检测技术研究[D].成都: 电子科技大学, 2016.YU ZH F. Research on optical noninvasive glucose measurement technology[D]. Chengdu: University of Electronic Science and Technology of China, 2016.(in Chinese) [36] PHAN Q H, LO Y L. Stokes-Mueller matrix polarimetry system for glucose sensing[J]. Optics and Lasers in Engineering, 2017, 92:120-128. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=8e7cf4a1537f29485779fbfe0558bf7a [37] 苏亚.光学相干层析无创血糖检测及其影响因素研究[D].天津: 天津大学, 2014.SU Y. The studies of noninvasive blood glucose monitoring using optical coherence tomography and factors affecting its accuracy[D]. Tianjin: Tianjin University, 2014.(in Chinese) [38] 付磊, 苏亚, 李果华, 等.广义极大似然估计在OCT无创血糖监测中的应用[J].激光与光电子学进展, 2016, 53(3):031701. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jgygdzxjz201603028FU L, SU Y, LI G H, et al..Application of maximum likelihood type estimates in noninvasive blood glucose monitoring in vivo using optical coherence tomography[J]. Laser & Optoelectronics Progress, 2016, 53(3):031701.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jgygdzxjz201603028 [39] HUANG D, SWANSON E A, LIN C P, et al..Optical coherence tomography[J]. Science, 1991, 254(5035):1178-1181. doi: 10.1126/science.1957169 [40] GHOSN M G, TUCHIN V V, LARIN K V. Nondestructive quantification of analyte diffusion in cornea and sclera using optical coherence tomography[J]. Investigative Ophthalmology & Visual Science, 2007, 48(6):2726-2733. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=ad975f2e7cf3fa79ce92d268ffa726e8 [41] TUCHIN V V. Optical clearing of tissues and blood using the immersion method[J]. Journal of Physics D:Applied Physics, 2005, 38(15):2497-2518. doi: 10.1088/0022-3727/38/15/001 [42] DE PRETTO L R, YOSHIMURA T M, RIBEIRO M S, et al.. Optical coherence tomography for blood glucose monitoring through signal attenuation[J]. Proceedings of SPIE, 2016, 9697:96973F. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=665cfef702748da7bfa6a35abbec50f2 [43] 苏亚, 孟卓, 王龙志, 等.光学相干层析无创血糖检测中相关性分析及标定[J].中国激光, 2014, 41(7):0704002. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgjg201407022SU Y, MENG ZH, WANG L ZH, et al.. Correlation analysis and calibration of noninvasive blood glucose monitoring in vivo with optical coherence tomography[J]. Chinese Journal of Lasers, 2014, 41(7):0704002.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgjg201407022 [44] 苏亚, 孟卓, 于海民, 等.OCT无创检测技术的人体血糖平衡延迟时间研究[J].激光技术, 2015, 39(1):19-22. http://d.old.wanfangdata.com.cn/Periodical/jgjs201501004SU Y, MENG ZH, YU H M, et al..Study on blood glucose lag time in noninvasive measurement using optical coherence tomography[J]. Laser Technology, 2015, 39(1):19-22.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/jgjs201501004 [45] DE PRETTO L R, YOSHIMURA T M, RIBEIRO M S, et al.. Optical coherence tomography for blood glucose monitoring in vitro through spatial and temporal approaches[J]. Journal of Biomedical Optics, 2016, 21(8):086007. doi: 10.1117/1.JBO.21.8.086007 [46] 刘蓉, 徐可欣, 陈文亮, 等.光学无创血糖检测中的主要问题及研究进展[J].中国科学G辑:物理学力学天文学, 2007, 37(S1):124-131. http://www.cnki.com.cn/Article/CJFDTotal-JGXK2007S1015.htmLIU R, XU K X, CHEN W L, et al..Primal problem and research progress of optical non-invasive blood glucose detection[J]. Science in China Series G-Physics, Mechanics & Astronomy, 2007, 37(S1):124-131.(in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-JGXK2007S1015.htm [47] 陈星旦, 高静, 丁海泉.论无创血糖监测的红外光谱方法[J].中国光学, 2012, 5(4):317-326. doi: 10.3969/j.issn.2095-1531.2012.04.003CHEN X D, GAO J, DING H Q. Infrared spectroscopy for non-invasive blood glucose monitoring[J]. Chinese Optics, 2012, 5(4):317-326.(in Chinese) doi: 10.3969/j.issn.2095-1531.2012.04.003 [48] CHEN J, ARNOLD M A, SMALL G W. Comparison of combination and first overtone spectral regions for near-infrared calibration models for glucose and other biomolecules in aqueous solutions[J]. Analytical Chemistry, 2004, 76(18):5405-5413. doi: 10.1021/ac0498056 [49] HEISE H M, DAMM U, KONDEPATI V R. Reliable long-term continuous blood glucose monitoring for patients in critical care using microdialysis and infrared spectrometry[J]. Proceedings of SPIE, 2006, 6093:609303. doi: 10.1117/12.650833 [50] YAMAKOSHI K I, YAMAKOSHI Y. Pulse glucometry:a new approach for noninvasive blood glucose measurement using instantaneous differential near-infrared spectrophotometry[J]. Journal of Biomedical Optics, 2006, 11(5):054028. doi: 10.1117/1.2360919 [51] LI G, WANG Y, LIN L, et al.. Dynamic spectrum: a brand-new non-invasive blood component measure method[C]. Proceedings of 2005 IEEE Engineering in Medicine and Biology 27th Annual Conference, IEEE, 2005: 1960-1963. [52] WANG Y, LI G, LIN L, et al.. Study on the error in the dynamic spectrum method relative with the path length factor as a function of wavelength[C]. Proceedings of 2005 IEEE Engineering in Medicine and Biology 27th Annual Conference, IEEE, 2005: 6679-6682. [53] 陈星旦.近红外光谱无创生化检验的可能性[J].光学 精密工程, 2008, 16(5):759-763. http://d.old.wanfangdata.com.cn/Periodical/gxjmgc200805001CHEN X D. Possibility of noninvasive clinical biochemical examination by near infrared spectroscopy[J]. Opt. Precision Eng., 2008, 16(5):759-763.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/gxjmgc200805001 [54] 丁海泉, 卢启鹏, 王动民, 等.近红外光谱无创血糖检测中有效信号提取方法的研究[J].光谱学与光谱分析, 2010, 30(1):50-53. doi: 10.3964/j.issn.1000-0593(2010)01-0050-04DING H Q, LU Q P, WANG D M, et al.. Research on the effective signal extraction in the noninvasive blood glucose sensing by near infrared spectroscopy[J]. Spectroscopy and Spectral Analysis, 2010, 30(1):50-53.(in Chinese) doi: 10.3964/j.issn.1000-0593(2010)01-0050-04 [55] 陈韵.近红外无创血糖测量-基准波长浮动基准法的研究[D].天津: 天津大学, 2009.CHEN Y. Study on reference wavelength method for non-invasive blood glucose sensing with near infrared spectroscopy[D]. Tianjin: Tianjin University, 2009.(in Chinese) [56] HEISE T, NOSEK L, GABLE J, et al.. ICU glucose monitoring measured in plasma using mid-infrared spectroscopy[J]. Critical Care, 2010, 14(S1):P580. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=PubMed000001354158 [57] KINO S, OMORI S, KATAGIRI T, et al.. Hollow optical-fiber based infrared spectroscopy for measurement of blood glucose level by using multi-reflection prism[J]. Biomedical Optics Express, 2016, 7(2):701-708. doi: 10.1364/BOE.7.000701 [58] LIAKAT S, BORS K A, XU L, et al.. Noninvasive in vivo glucose sensing on human subjects using mid-infrared light[J]. Biomedical Optics Express, 2014, 5(7):2397-2404. doi: 10.1364/BOE.5.002397 [59] YOSHIOKA K, KINO S, MATSUURA Y. Noninvasive measurement of blood glucose level using mid-infrared quantum cascade lasers[J]. Proceedings of SPIE, 2017, 10251:102511U. doi: 10.1117/12.2275006 [60] 李刚, 周梅, 吴红杰, 等.无创人体血糖检测光学方法的研究现状与发展[J].光谱学与光谱分析, 2010, 30(10):2744-2747. doi: 10.3964/j.issn.1000-0593(2010)10-2744-04LI G, ZHOU M, WU H J, et al.. The research status and development of noninvasive glucose optical measurements[J]. Spectroscopy and Spectral Analysis, 2010, 30(10):2744-2747.(in Chinese) doi: 10.3964/j.issn.1000-0593(2010)10-2744-04 [61] SHIH W C, BECHTEL K L, REBEC M V. Noninvasive glucose sensing by transcutaneous Raman spectroscopy[J]. Journal of Biomedical Optics, 2015, 20(5):051036. doi: 10.1117/1.JBO.20.5.051036 [62] PANDEY R, PAIDI S K, VALDEZ T A, et al.. Noninvasive monitoring of blood glucose with Raman spectroscopy[J]. Accounts of Chemical Research, 2017, 50(2):264-272. doi: 10.1021/acs.accounts.6b00472 [63] 凌明胜, 钱志余, 梁超英.血糖浓度荧光光谱检测研究[J].量子电子学报, 2007, 24(5):635-639. doi: 10.3969/j.issn.1007-5461.2007.05.020LING M SH, QIAN ZH Y, LIANG CH Y. Research on blood glucose concentration monitoring by fluorescence spectrum[J]. Chinese Journal of Quantum Electronics, 2007, 24(5):635-639.(in Chinese) doi: 10.3969/j.issn.1007-5461.2007.05.020 [64] SRINIVASAN G, CHEN J, PARISI J, et al..An injectable PEG-BSA-Coumarin-GOx hydrogel for fluorescence turn-on glucose detection[J]. Applied Biochemistry and Biotechnology, 2015, 177(5):1115-1126. doi: 10.1007/s12010-015-1800-2 [65] 李爱琴, 郭唱, 许苏英.高灵敏检测葡萄糖的新型荧光纳米传感器[J].分析化学, 2017, 45(6):824-829. http://d.old.wanfangdata.com.cn/Periodical/fxhx201706006LI A Q, GUO CH, XU S Y. A novel fluorescence sensor for highly sensitive detection of glucose[J]. Chinese Journal of Analytical Chemistry, 2017, 45(6):824-829.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201706006 [66] FLOWER O J, BIRD S, MACKEN L, et al..Continuous intra-arterial blood glucose monitoring using quenched fluorescence sensing:a product development study[J]. Critical Care and Resuscitation, 2014, 16(1):54-61. http://cn.bing.com/academic/profile?id=fe6588e19e47b1a3332f13239bb5fea0&encoded=0&v=paper_preview&mkt=zh-cn [67] STRASMA P J, FINFER S, FLOWER O, et al..Use of an intravascular fluorescent continuous glucose sensor in ICU patients[J]. Journal of Diabetes Science and Technology, 2015, 9(4):762-770. doi: 10.1177/1932296815585872 [68] QUAN K M, CHRISTISON G B, MACKENZIE H A, et al.. Glucose determination by a pulsed photoacoustic technique:an experimental study using a gelatin-based tissue phantom[J]. Physics in Medicine & Biology, 1993, 38(12):1911-1922. doi: 10.1088-0031-9155-38-12-014/ [69] TAM A C. Applications of photoacoustic sensing techniques[J]. Reviews of Modern Physics, 1986, 58(2):381-431. doi: 10.1103/RevModPhys.58.381 [70] PATEL C K N, TAM A C. Pulsed optoacoustic spectroscopy of condensed matter[J]. Reviews of Modern Physics, 1981, 53(3):517-550. doi: 10.1103/RevModPhys.53.517 [71] NELSON E T, PATEL C K N. Response of piezoelectric transducers used in pulsed optoacoustic spectroscopy[J]. Optics Letters, 1981, 6(7):354-356. doi: 10.1364/OL.6.000354 [72] NAMITA T, SATO M, KONDO K, et al.. Evaluation of blood glucose concentration measurement using photoacoustic spectroscopy in near-infrared region[J]. Proceedings of SPIE, 2017, 10064:100645A. doi: 10.1117/12.2252532 [73] 石小巍, 肖啸.基于光声效应的无创血糖检测仪的研究[J].红外, 2009, 30(1):20-23. http://d.old.wanfangdata.com.cn/Periodical/hongw200901005SHI X W, XIAO X. Research on noninvasive blood glucose detector based on optoacoustic effect[J]. Infrared, 2009, 30(1):20-23.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/hongw200901005 [74] PAI P P, SANKI P K, SARANGI S, et al.. Modelling, verification, and calibration of a photoacoustics based continuous non-invasive blood glucose monitoring system[J]. Review of Scientific Instruments, 2015, 86(6):064901. doi: 10.1063/1.4922416 [75] REN ZH, LIU G D, HUANG ZH, et al.. Laser-induced photoacoustic glucose spectrum denoising using an improved wavelet threshold translation-invariant algorithm[J]. Proceedings of SPIE, 2009, 7382:73822R. doi: 10.1117/12.835004 [76] 谭毅, 李长辉.成像深度对光声层析成像的影响[J].中国光学, 2016, 9(5):515-522. http://www.chineseoptics.net.cn/CN/abstract/abstract9453.shtmlTAN Y, LI CH H. Influence of imaging depth on photoacoustic tomography[J]. Chinese Optics, 2016, 9(5):515-522.(in Chinese) http://www.chineseoptics.net.cn/CN/abstract/abstract9453.shtml [77] ZHU L L, LI H, CAI J L, et al.. Propagation of diffused light modulated by a focused ultrasound in scattering media[J]. Proceedings of SPIE, 2006, 6047:60470B. http://cn.bing.com/academic/profile?id=7f338acd223445304b7f2592da79d2bd&encoded=0&v=paper_preview&mkt=zh-cn [78] 王姝蕾.无创血糖近红外光谱信号检测与处理技术研究[D].北京: 北京邮电大学2018: 47-50.WANG SH L. Research on the technology of noninvasive blood glucose near-infrared spectroscopy signal detection and processing[D]. Beijing: Beijing University of Posts and Telecommunications, 2018: 47-50.(in Chinese) [79] SHAW R A, KOTOWICH S, LEROUX M, et al..Multianalyte serum analysis using mid-infrared spectroscopy[J]. Annals of Clinical Biochemistry:International Journal of Laboratory Medicine, 1998, 35(5):624-632. doi: 10.1177/000456329803500505 [80] SHEN Y C, DAVIES A G, LINFIELD E H, et al.. The use of fourier-transform infrared spectroscopy for the quantitative determination of glucose concentration in whole blood[J]. Physics in Medicine and Biology, 2003, 48(13):2023-2032. doi: 10.1088/0031-9155/48/13/313 [81] KINO S, OMORI S, MATSUURA Y. Blood glucose measurement in vivo using hollow-fiber based, mid-infrared ATR probe with multi-reflection prism[J]. Proceedings of SPIE, 2016, 9702:970209. http://cn.bing.com/academic/profile?id=ed8de262bdd2e4e56e197473420afa5d&encoded=0&v=paper_preview&mkt=zh-cn [82] 任重, 刘国栋, 黄振.基于可调谐脉冲激发的血糖浓度光声无损检测研究[J].中国激光, 2016, 43(2):0204001. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgjg201602016REN ZH, LIU G D, HUANG ZH. Study on photoacoustic noninvasive detection for blood glucose concentration based on tunable pulsed laser[J]. Chinese Journal of Lasers, 2016, 43(2):0204001.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgjg201602016 [83] PLEITEZ M A, LIEBLEIN T, BAUER A, et al.. In vivo noninvasive monitoring of glucose concentration in human epidermis by mid-infrared pulsed photoacousticspectroscopy[J]. Analytical Chemistry, 2013, 85(2):1013-1020. doi: 10.1021/ac302841f -






 下载:
下载: