Spectral analysis and theoretical modeling of the working mechanism of meloxicam and lysozyme
-
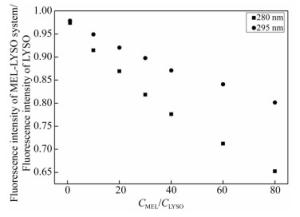
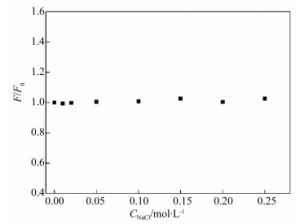
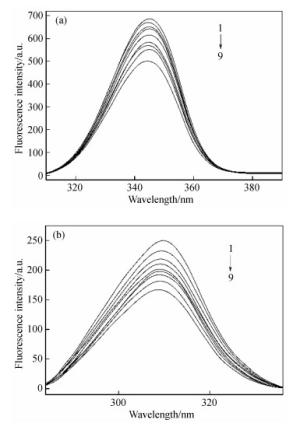
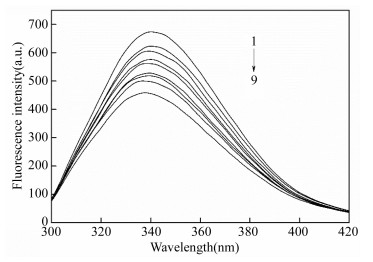
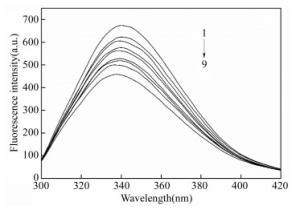
摘要: 为了探究美洛昔康与溶菌酶的作用机制,在pH=7.40的实验条件下,采用荧光光谱、同步荧光光谱和理论模建分析技术研究了类风湿性关节炎药物美洛昔康与溶菌酶分子之间的相互作用。结果表明,美洛昔康能够以静态猝灭形式有效地猝灭溶菌酶的内源荧光,形成1:1的复合物,并使溶菌酶的构象发生改变。热力学结果表明,美洛昔康-溶菌酶体系的主要作用力类型为疏水作用力。理论模建结果表明,该体系除疏水作用外还存在氢键作用,且美洛昔康被溶菌酶的活性氨基酸残基Glu35和Asp52包围,结合作用改变了溶菌酶催化活性中心处氨基酸残基的微环境。当患者服用15 mg美洛昔康时,美洛昔康与溶菌酶的蛋白结合率W(B)为3.71%~8.79%,说明美洛昔康与溶菌酶的结合对溶菌酶自身抗炎、抗菌功能的影响不大,体系药物结合率W(Q)为1.08%~1.14%,说明溶菌酶与美洛昔康结合不会影响美洛昔康的药效。该研究从理论上证明了溶菌酶在血浆环境中与药物美洛昔康结合后,对溶菌酶本身功能和美洛昔康的药效不会产生严重影响。Abstract: In order to explore the active mechanisms of meloxicam and lysozyme, the interaction between the molecules of rheumatoid arthritis drugs, meloxicam and lysozyme was studied using fluorescence spectroscopy, synchronous fluorescence spectroscopy and theoretical modeling analysis under the pH=7.40 experimental conditions. The results showed that meloxicam was able to effectively quench the endogenous fluorescence of lysozyme, forming a 1:1 complex and changing the conformation of lysozyme. Thermodynamic results indicated that the main type of meloxicam-lysozyme system was a hydrophobic interaction. The results of theoretical modeling indicated that the system had hydrogen bonds in addition to hydrophobic interactions and that meloxicam was surrounded by the active amino acid residues Glu35 and Asp52 from the lysozyme, which changed the microenvironment of amino acid residues at the active center of the lysozyme. When a patient took meloxicam 15 mg, the protein binding rate of meloxicam to lysozyme W(B) was 3.71%~8.79%, indicating that the combination of meloxicam and lysozyme has little effect on anti-inflammatory and antibacterial function of lysozyme itself, and the system drug binding rate W(Q) was 1.08%~1.14%, indicating that the combination of lysozyme and meloxicam does not affect the efficacy of meloxicam. This study theoretically proved that lysozyme does not have a serious effect on its own function or the efficacy of meloxicam after it is combined with meloxicam in plasma.
-
Key words:
- meloxicam /
- lysozyme /
- fluorescence analysis /
- theoretical modeling /
- binding rate
-
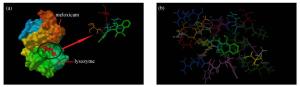
图 5 MEL与LYSO相互作用的理论模建图。(a) MEL与LYSO发生作用区域及MEL与LYSO的氨基酸残基之间的氢键; (b) MEL与LYSO结合部位的氨基酸残基分布情况
Figure 5. Theoretical modeling of the interaction between MEL and LYSO. (a) Regions where MEL interacts with LYSO and hydrogen bonds between docked MEL and amino acids residues of LYSO; (b) Distribution of amino and residues at the bonding site of MEL and LYSO
表 1 不同温度下MEL-LYSO体系的猝灭反应参数
Table 1. Quenching reactive parameters of MEL-LYSO at different temperatures
λex/(nm) T/(K) Kq/(L·mol-1·s-1) Ksv/(L·mol-1) r1 Ka/(L·mol-1) n r2 280 293 2.08×1012 2.08×104 0.993 2 2.34×104 1.08 0.992 2 308 1.59×1012 1.59×104 0.993 9 1.71×104 1.06 0.996 9 318 1.28×1012 1.28×104 0.995 7 1.31×104 1.22 0.995 6 295 293 1.53×1012 1.53×104 0.993 8 1.62×104 1.17 0.994 2 308 1.18×1012 1.18×104 0.996 5 1.23×104 1.12 0.996 9 318 0.89×1012 0.89×104 0.997 4 0.93×104 1.03 0.991 5 注:r1为方程F0 /F~[L]的线性相关系数; r2为方程lg[(F0-F)/F]~lg{[L]-n[Bt](F0-F)/F0}的线性相关系数;[Bt]=5.0×10-7 mol/L 表 2 不同温度下MEL-LYSO体系的热力学参数(λex=280 nm)
Table 2. The thermodynamic parameters of MEL-LYSO at different temperatures(λex=280 nm)
T/K Ka/L·mol-1 ΔH/kJ·mol-1 ΔS/J·mol-1·K-1 ΔG/kJ·mol-1 298 2.34×104 7.82 -24.93 310 1.71×104 -22.59 8.15 -25.12 318 1.31×104 7.76 -25.06 表 3 MEL-LYSO体系的对接能量(单位:kJ/mol)
Table 3. Docking energy of MEL-LYSO system (unit: kJ/mol)
Protein PDB ID ΔG0 ΔE1 ΔE2 ΔE3 2LYZ -27.81 -31.53 -31.11 -0.42 -
[1] FRANZE J A, CARVALHO T F, GAGLIERI C, et al.. Synthesis, characterization, thermal and spectroscopic studies and bioactivity of complexes of meloxicam with some bivalent transition metals[J]. Journal of Thermal Analysis and Calorimetry, 2017, 127(2):1393-1405. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=ab4d75eeed6f7e4df3d2a9f9c5049c86 [2] SAYEN S, CARLIER A, TARPIN M, et al.. A novel copper(Ⅱ) mononuclear complex with the non-steroidal anti-inflammatory drug diclofenac:structural characterization and biological activity[J]. Journal of Inorganic Biochemistry, 2013, 120(3):39-43. https://www.sciencedirect.com/science/article/pii/S0162013412003881 [3] EBRAHIMI M, KHAYAMIAN T, HADADZADEH H, et al.. Spectroscopic, biological, and molecular modeling studies on the interactions of[Fe(Ⅲ)-meloxicam] with G-quadruplex DNA and investigation of its release from bovine serum albumin (BSA) nanoparticles[J]. Journal of Biomolecular Structure and Dynamics, 2015, 33(11):2316-2329. doi: 10.1080/07391102.2014.1003195 [4] 王哲, 薛敏, 孟子晖, 等.水凝胶纳米颗粒对溶菌酶的亲和研究[J].分析化学, 2018, 46(3):317-323. http://d.old.wanfangdata.com.cn/Periodical/fxhx201803004WANG ZH, XUE M, MENG Z H, et al.. Affinity of hydrogel nanoparticles to lysozyme[J]. Chinese Journal of Analytical Chemistry, 2018, 46(3):317-323. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201803004 [5] 张勇, 刘劲风, 易润豪, 等.一种黄酮类荧光探针的合成及用于肼的检测[J].分析化学, 2018, 46(4):511-516. http://d.old.wanfangdata.com.cn/Periodical/fxhx201804007ZHANG Y, LIU J F, YI R H, et al. Synthesis and application of a flavone-based fluorescent probe for detection of hydrazine[J].Chinese Journal of Analytical Chemistry, 2018, 46(4):511-516. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201804007 [6] 曹津津, 孙启瑞, 李文红, 等.木兰花碱的荧光性质及其在中药分析中的应用研究[J].分析化学, 2019, 47(6):950-956. http://d.old.wanfangdata.com.cn/Periodical/fxhx201906020CAO J J, SUN Q R, LI W H, et al. Fluorescence properties of magnoflorine and its application in analysis of traditional Chinese medicine[J]. Chinese Journal of Analytical Chemistry, 2019, 47(6):950-956. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201906020 [7] WANG J J, LIU B SH, BIAN G, et al.. Reaction mechanism of tylosin tartrate with lysozyme[J]. Spectroscopy Letters, 2017, 50(3):125-129. doi: 10.1080/00387010.2017.1287099 [8] 颜娟, 郑茂东, 崔玉环, 等.牡荆苷与溶菌酶相互作用的荧光光谱学研究[J].现代药物与临床, 2017, 32(2):175-178. http://d.old.wanfangdata.com.cn/Periodical/gwyy-zwyfc201702003YAN J, ZHENG M D, CUI Y H, et al.. Fluorescence spectroscopy of interactions between vitexin and lysozyme[J]. Drugs & Clinic, 2017, 32(2):175-178. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/gwyy-zwyfc201702003 [9] 陈晨, 张洪峰, 王乐, 等.荧光光谱法研究奥沙利铂与溶菌酶的相互作用[J].药品评价, 2015, 12(4):30-33. doi: 10.3969/j.issn.1672-2809.2015.04.006CHEN CH, ZHANG H F, WANG L, et al.. Studies on the interaction between oxaliplatin and lysozyme by fluorescence spectrometry[J]. Drug Evaluation, 2015, 12(4):30-33. (in Chinese) doi: 10.3969/j.issn.1672-2809.2015.04.006 [10] FANG Q, WANG Y R, GUO CH H, et al.. Interaction between fleroxacin and lysozyme by using multi-spectral techniques and molecular docking[J]. Spectroscopy and Spectral Analysis, 2018, 38(2):654-659. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=gpxygpfx201802054 [11] GÖKOLU E, YILMAZ E. Fluorescence interaction and determination of sulfathiazole with trypsin[J]. Journal of Fluorescence, 2014, 24(5):1439-1445. doi: 10.1007/s10895-014-1427-7 [12] 许凤杰, 彪林海, 祖元刚, 等.丹皮酚与钙粘素相互作用的分析研究[J].分析化学, 2017, 45(7):1025-1030. http://d.old.wanfangdata.com.cn/Periodical/fxhx201707014XU F J, BIAO L H, ZU Y G, et al. Study on interactions between paeonol and cadherin[J]. Chinese Journal of Analytical Chemistry, 2017, 45(7):1025-1030. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201707014 [13] 曹团武, 周坤, 黄文兵, 等.光谱法研究哈巴俄苷与人血清白蛋白的结合反应[J].分析化学, 2017, 45(5):700-706. http://d.old.wanfangdata.com.cn/Periodical/fxhx201705012CAO T W, ZHOU K, HUANG W B, et al.. Spectroscopic study of interaction of harpagoside and human serum albumin[J]. Chinese Journal of Analytical Chemistry, 2017, 45(5):700-706. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201705012 [14] 申炳俊, 金丽虹, 刘昱鑫, 等.荧光光谱结合表面增强拉曼光谱法研究紫檀芪与人血清白蛋白相互作用[J].分析化学, 2017, 45(11):1613-1620. doi: 10.11895/j.issn.0253-3820.170341SHEN B J, JIN L H, LIU Y X, et al.. Study of intermolecular interactions between pterostilbene and human serum albumin by fluorescence spectrometry-surface enhanced Raman spectroscopy[J]. Chinese Journal of Analytical Chemistry, 2017, 45(11):1613-1620. (in Chinese) doi: 10.11895/j.issn.0253-3820.170341 [15] CAO SH N, LIU B SH, LI ZH Y, et al.. A fluorescence spectroscopic study of the interaction between glipizide and bovine serum albumin and its analytical application[J]. Journal of Luminescence, 2014, 145:94-99. doi: 10.1016/j.jlumin.2013.07.026 [16] AMROABADI M K, TAHERI-KAFRANI A, SAREMI L H, et al.. Spectroscopic studies of the interaction between alprazolam and Apo-human serum transferrin as a drug carrier protein[J]. International Journal of Biological Macromolecules, 2018, 108:263-271. doi: 10.1016/j.ijbiomac.2017.11.179 [17] HU Y J, YANG Y O, DAI CH M, et al.. Site-selective binding of human serum albumin by palmatine:spectroscopic approach[J]. Biomacromolecules, 2010, 11(1):106-112. doi: 10.1021/bm900961e [18] SALAM M A, ROKONUJJAMAN M, RAHMAN A, et al.. Study of in vitro interaction of sildenafil citrate with bovine serum albumin by fluorescence spectroscopy[J]. Pharmacology & Pharmacy, 2015, 6(2):94-101. http://cn.bing.com/academic/profile?id=dd6afe9c7c435f8a1a5255032018ebc4&encoded=0&v=paper_preview&mkt=zh-cn [19] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions:forces contributing to stability[J]. Biochemistry, 1981, 20(11):3096-3102. doi: 10.1021/bi00514a017 [20] 马雪红, 宋百灵, 肖文浚, 等.蒜氨酸与牛及人血清白蛋白的相互作用[J].光谱学与光谱分析, 2017, 37(6):1826-1830. http://d.old.wanfangdata.com.cn/Periodical/gpxygpfx201706033MA X H, SONG B L, XIAO W J, et al.. Study on interaction between alliin and bovine and hunman serum albumin with spectrometry[J]. Spectroscopy and Spectral Analysis, 2017, 37(6):1826-1830. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/gpxygpfx201706033 [21] ZHOU H F, BI SH Y, WANG Y, et al.. Characterization of the binding of paylean and DNA by fluorescence, UV spectroscopy and molecular docking techniques[J]. Luminescence, 2016, 31(4):1013-1019. doi: 10.1002/bio.3066 [22] 李雪, 曹君, 白新鹏, 等.同步荧光法监控人乳脂质替代品氧化过程[J].分析化学, 2018, 46(4):543-549. http://d.old.wanfangdata.com.cn/Periodical/fxhx201804012LI X, CAO J, BAI X P, et al. Monitoring of oxidation process of human milk lipid substitutes by molecular fluorescence spectroscopy[J]. Chinese Journal of Analytical Chemistry, 2018, 46(4):543-549. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/fxhx201804012 [23] BUDDANAVAR A T, NANDIBEWOOR S T. Multi-spectroscopic characterization of bovine serum albumin upon interaction with atomoxetine[J]. Journal of Pharmaceutical Analysis, 2017, 7(3):148-155. doi: 10.1016/j.jpha.2016.10.001 [24] XU CH B, GU J L, MA X P, et al.. Investigation on the interaction of pyrene with bovine serum albumin using spectroscopic methods[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2014, 125:391-395. doi: 10.1016/j.saa.2014.01.132 [25] JING M Y, SONG W, LIU R T. Binding of copper to lysozyme:spectroscopic, isothermal titration calorimetry and molecular docking studies[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 164:103-109. doi: 10.1016/j.saa.2016.04.008 [26] JANA S, DALAPATI S, GHOSH S, et al.. Study of microheterogeneous environment of protein human serum albumin by an extrinsic fluorescent reporter:a spectroscopic study in combination with molecular docking and molecular dynamics simulation[J]. Journal of Photochemistry and Photobiology B:Biology, 2012, 112:48-58. doi: 10.1016/j.jphotobiol.2012.04.007 [27] MA L H, LIU B SH, WANG CH D, et al.. The interaction mechanism of nifedipine and pepsin[J]. Monatshefte für Chemie-Chemical Monthly, 2018, 149(11):2123-2130. doi: 10.1007/s00706-018-2269-9 [28] 李长印, 张军, 戴国良, 等.美洛昔康分散片在健康人体内的药代动力学和生物等效性研究[J].中国药物与临床, 2012, 12(4):424-427. doi: 10.3969/j.issn.1671-2560.2012.04.004LI CH Y, ZHANG J, DAI G L, et al.. In vivo pharmacokinetics and bioequivalence of meloxicam dispersion tablets in healthy volunteers[J]. Chinese Remedies & Clinics, 2012, 12(4):424-427. (in Chinese) doi: 10.3969/j.issn.1671-2560.2012.04.004 [29] REN R, YU ZH T, ZOU Y M, et al.. Enhancing the sensitivity of aptameric detection of lysozyme with a "feed-forward" network of DNA-related reaction cycles[J]. Chemistry-A European Journal, 2012, 18(44):14201-14209. doi: 10.1002/chem.201102742 -





 下载:
下载: