Abstract:
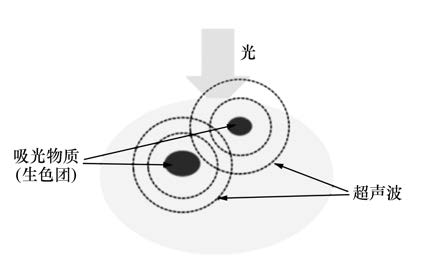
Photoacoustic imaging has obtained the widespread attention in the world due to its high resolution, high contrast and deep imaging depth
etc. This paper describes the principles of photoacoustic imaging, the process of its generation, propagation and detection, reconstruction algorithms and its applications in clinical medicine, and also summarizes the progress of photoacoustic imaging, as well as their individual features. According to the analysis, photoacoustic imaging is thought to have many advantages, which other medical imaging techniques do not have, as well as a broad application prospect and high application value. And in the future, photoacoustic imaging will become one of the most important biomedical imaging techniques, and make outstanding contributions for the realization of real-time medical imaging.






 下载:
下载: